
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有 )。
A.碱性:KOH>NaOH B.相对原子质量:Ar<K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
科目:高中化学 来源: 题型:
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)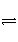
 N2O4(g) ΔH<0
N2O4(g) ΔH<0
反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是( )
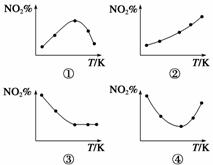
A.①② B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
甲醇脱水反应
2CH3OHg)===CH3OCH3g)+H2Og)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OHg)===C2H4g)+2H2Og)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OHg)===CH3OCH3g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4g)+H2Og)===C2H5OHg)的ΔH=________kJ·mol-1。
2)[2012·广东理综,314)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Lis)+I2s)===2Lis) ΔH
已知:4Lis)+O2g)===2Li2Os) ΔH1
4LiIs)+O2g)===2I2s)+2Li2Os) ΔH2
则电池反应的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 )。
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,A池用石墨电极电解pH=13氢氧化钠溶液(100 mL),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止,A池a极产生的气体在标准状况下为2.24 L,则下列说法正确的是(双选)( )。

A.d电极质量一定减少6.4 g
B.c电极质量一定增加6.4 g
C.A池pH增大
D.A池溶液质量减少3.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
S-诱抗素制剂能保持鲜花盛开,S-诱抗素的分子结构
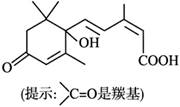 如图,下列关于该物质说法正确的是
如图,下列关于该物质说法正确的是
A. S-诱抗素制剂能发生酯化反应的官能团有2种
B. 含有苯环、羟基、羰基、羧基、碳碳双键
C. 1 mol S-诱抗素制剂与足量金属Na反应生成0.5 mol H2
D. 该化合物不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(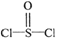 )中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响。
B.金属锂作电池的正极,石墨作电池的负极。
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3。
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:l。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com