
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:

已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸汽在标准状况下密度为2.5g·L-1;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
② 其中R为烃基
其中R为烃基
③ 其中R1和R2均为烃基
其中R1和R2均为烃基
回答下列问题:
(1)A的结构简式为________________________________;
(2)反应④的化学方程式为_________________________________;
(3)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有______________种;
(4)反应①~⑦属于取代反应的是________________________(填序号);
(5)反应⑦的化学方程式为________________________________;
(6)参照上述合成路线,以  为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料 ________________________。
________________________。
【答案】 ![]()
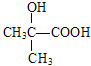
![]()
![]() +H2O 8 ②⑤⑥⑦ 2
+H2O 8 ②⑤⑥⑦ 2![]() +
+![]()
![]()
![]() +2H2O
+2H2O ![]()
![]()
![]()
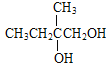
![]()
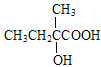
![]()

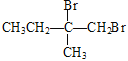
【解析】A的蒸汽在标准状况下密度为2.5gL-1,A的相对分子质量为56,属于脂肪烃,A中碳原子个数=![]() =4…8,分子式为C4H8,根据核磁共振氢谱显示有2组峰,面积比为3:1,结合流程图知,B是溴代烃、C是醇,C被酸性高锰酸钾溶液氧化生成D,根据D分子式知,C中有一个羟基不能被氧化,则A为CH2=C(CH3)2,B为CH2BrCBr(CH3)2,C为CH2OHCOH(CH3)2,D为HOOCCOH(CH3)2,E分子式为C4H6O2,能使溴水褪色,D发生消去反应生成E,E为HOOCC(CH3)=CH2,E发生信息③的反应生成F,F为HOOCC(CH3)CH2COOH,H和F发生酯化反应生成I,根据I分子式知,H为
=4…8,分子式为C4H8,根据核磁共振氢谱显示有2组峰,面积比为3:1,结合流程图知,B是溴代烃、C是醇,C被酸性高锰酸钾溶液氧化生成D,根据D分子式知,C中有一个羟基不能被氧化,则A为CH2=C(CH3)2,B为CH2BrCBr(CH3)2,C为CH2OHCOH(CH3)2,D为HOOCCOH(CH3)2,E分子式为C4H6O2,能使溴水褪色,D发生消去反应生成E,E为HOOCC(CH3)=CH2,E发生信息③的反应生成F,F为HOOCC(CH3)CH2COOH,H和F发生酯化反应生成I,根据I分子式知,H为![]() ,甲苯发生取代反应生成G,G为
,甲苯发生取代反应生成G,G为![]() ;I为
;I为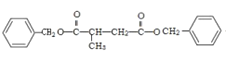 。
。
根据上述分析,A为CH2=C(CH3)2,B为CH2BrCBr(CH3)2,C为CH2OHCOH(CH3)2,D为HOOCCOH(CH3)2,E为HOOCC(CH3)=CH2,F为HOOCC(CH3)CH2COOH;H为![]() ,G为
,G为![]() ;I为
;I为 。
。
(1)A的结构简式为CH2=C(CH3)2,故答案为:CH2=C(CH3)2;
(2)D为HOOCCOH(CH3)2,E为HOOCC(CH3)=CH2,反应④的化学方程式为: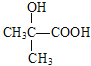
![]()
![]() +H2O,故答案为:
+H2O,故答案为: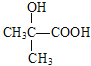
![]()
![]() +H2O;
+H2O;
(3)E为HOOCC(CH3)=CH2,E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的同分异构体说明含有酯基和醛基,应该是甲酸某酯,丁烯醇中,4个碳原子在同一链上时有6种;3个C原子在同一链上时有2种,所以符合条件的有8种,故答案为:8;
(4)根据上述分析,反应①为加成反应,反应②为水解反应,属于取代反应,反应③为氧化反应,反应④为消去反应,反应⑤为取代反应,反应⑥为水解反应,反应⑦为酯化反应,属于取代反应的是②⑤⑥⑦,故答案为:②⑤⑥⑦;
(5)反应⑦的化学方程式为2![]() +
+![]()
![]()
![]() +2H2O,故答案为:2
+2H2O,故答案为:2![]() +
+![]()
![]()
![]() +2H2O ;
+2H2O ;
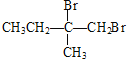
(6)![]() 和溴发生加成反应生成CH2BrCBr(CH3)CH2CH3,CH2BrCBr(CH3)CH2CH3碱性条件下发生水解反应生成CH2OHCOH(CH3)CH2CH3,CH2OHCOH(CH3)CH2CH3被酸性高锰酸钾溶液氧化生成
和溴发生加成反应生成CH2BrCBr(CH3)CH2CH3,CH2BrCBr(CH3)CH2CH3碱性条件下发生水解反应生成CH2OHCOH(CH3)CH2CH3,CH2OHCOH(CH3)CH2CH3被酸性高锰酸钾溶液氧化生成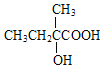 ,
,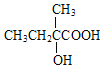 发生酯化反应生成
发生酯化反应生成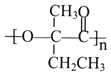 ,其合成路线为
,其合成路线为![]()
![]()
![]()
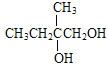
![]()
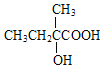
![]()
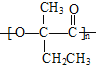 ,故答案为:
,故答案为:![]()
![]()

![]()
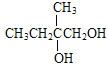
![]()
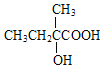
![]()
 。
。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
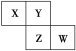
A. W的氧化物对应的水化物是强酸B. 原子半径:X﹥Y
C. Z单质氧化性强于Y单质D. X的氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH4+、CO32、Cl、SO32、SO42。某同学为确定其成分,设计并完成以下实验(不考虑水解,所加试剂均足量):
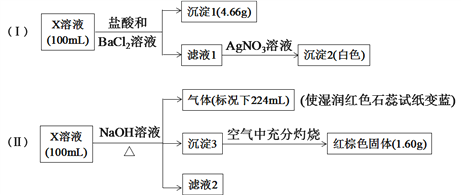
下列说法正确的是
A. X溶液中一定存在Na+、SO32、SO42、CO32
B. X溶液中一定存在NH4+、Na+、SO42,至少含有Fe3+、Fe2+离子中的一种
C. 取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+
D. X溶液中一定含有Cl,且c(Cl)≥0.1mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应的方程式:①2Fe3++2I-=2Fe2++I2;②Br2+2Fe2+=2Br-+2Fe3+,可判断各物质的氧化性由强到弱的顺序是
A.Fe3+、Br2、I2B.Fe3+、I2、Br2
C.Br2、Fe3+、I2D.Br2、I2、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,苯的化学性质比较稳定,这是因为 ( )
A.苯不能使高锰酸钾酸性溶液褪色B.苯不与溴水发生加成反应
C.苯的分子结构决定的D.苯是芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
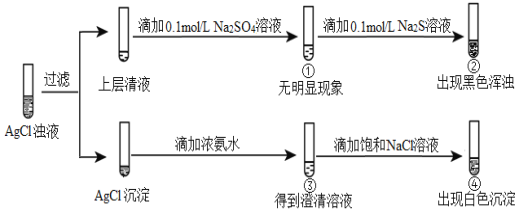
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为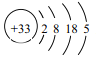 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。
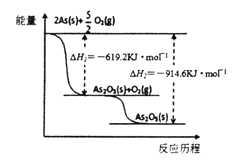
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。常温下0.1mol·L-1 NaHC2O4溶液(pH约为4)中指定微粒的物质的量浓度关系错误的是
A. c(Na+)= c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)
)+c(H2C2O4)
B. c(HC2O4-)>c(H2C2O4)>c(C2O![]() )
)
C. c(Na+)+c(H+)=c(HC2O![]() )+ c(C2O
)+ c(C2O![]() )+c(OH-)
)+c(OH-)
D. c(H2C2O4)+c(H+)=c(C2O![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com