
A.所含质子数为(A-n)
B.所含中子数为(A-Z)
C.所含电子数为(Z+n)
D.中子数-电子数为A-2Z+n
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源:2011-2012学年福建省三明一中高二下学期第一次月考化学试卷(带解析) 题型:填空题
(15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
| 族 周期 | IA | | 0 | |||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | B | C | D | | |
| 3 | E | | F | G | | | K | |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省衡水中学高二下学期期末考试化学试卷(带解析) 题型:填空题
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为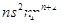 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
B |
C |
D |
|
|
|
3 |
E |
|
F |
G |
|
|
K |
|
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。

查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期末考试化学试卷(解析版) 题型:推断题
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
|
元素 |
相关信息 |
|
T |
T原子所处的周期数、族序数分别与其原子序数相等 |
|
X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
|
Z |
Z的基态原子价电子排布为 |
|
Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
|
R |
3p能级上有1个电子 |
|
W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
M、A、B、C、D、E是六种短周期元素,它们的原子序数依次增大。M是有机物必含的元素;A元素的最高价氧化物对应的水化物与其气态氢化物反应生成一种盐X;C、D、E三种元素的最高价氧化物对应的水化物间两两皆能反应;E元素的最外层电子数是其次外层电子数的3/4倍;A、C、E三元素均能与B元素形成原子个数比不同的若干化合物。请回答下列问题:
(1)B、C两元素的原子可形成粒子个数比1:2的物质,请用电子式表示其形成过程
。
(2)写出C、D元素各自的最高价氧化物对应的水化物反应的离子方程式 。
(3)A、B气态氢化物的稳定性由强到弱的顺序是: (用分子式表示)。
(4)B、C、D、E四种元素的简单离子的离子半径由大到小的顺序是 (用离子符号表示)。
(5)向含有amolD的氯化物的水溶液中加入含bmolC的最高价氧化物对应的水化物的溶液,生成沉淀的物质的量不可能为 。
①amol ②bmol ③a/3mol ④b/3mol ⑤0 ⑥(4a-b)mol
(6)M和最简单原子的元素形成的某化合物,其密度是同温同压下氢气密度的36倍,该化合物的分子式为 ,若该化合物所形成的一氯代物只有一种,则该化合物的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com