
分析 在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,所以3molCu是还原剂,N元素的化合价降低,所以2mol硝酸是氧化剂,据此回答.
解答 解:在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,所以3molCu是还原剂,Cu(NO3)2 是氧化产物,N元素的化合价降低,所以2mol硝酸是氧化剂,则氧化剂与还原剂的物质的量之比为2:3,反应中转移6mol电子,即转移的电子数为6NA;
故答案为:HNO3;Cu(NO3)2;2:3;6NA.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,氧化剂和还原剂的判断及计算的考查,注意从化合价角度分析,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃是透明的属于晶体 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 石灰石是制造陶瓷的主要原料 | D. | 纯碱是制取水泥的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应 | B. | 盐酸和碳酸氢钠溶液 | ||
| C. | 铜与硝酸反应 | D. | 氯化铝溶液和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①和②互为同分异构体,①和④互为同系物 | |
| B. | ④的一氯代物有三种 | |
| C. | ②不可能由烯烃与氢气加成而获得 | |
| D. | 能通过加氢反应得到③的炔烃有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能位第三周期 | B. | Xn-一定有3个电子层 | ||
| C. | Y的原子序数不大于7 | D. | Y不可能位于第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中可能含有K+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、AlO2-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
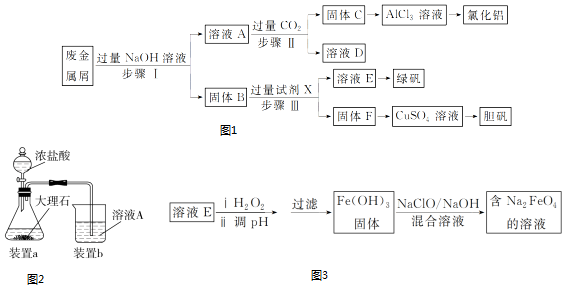
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com