
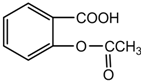
 如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )
如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )| A. | 阿斯匹林的化学式为C9H8O4 | |
| B. | 该化合物具有酸性,能与 NaOH 或 NaHCO3反应 | |
| C. | 1 mol 该化合物与足量的 NaOH溶液反应,消耗 NaOH最大的物质的量为2 mol | |
| D. | 纯净的 Aspirin 不能与 FeCl3溶液反应,但它的水解产物能使FeCl3溶液显色 |
分析 该分子中含有苯环、羧基和酯基,具有苯、羧酸和酯的性质,能发生加成反应、取代反应、中和反应、水解反应等,据此分析解答.
解答 解:A.根据结构简式确定分子式为C9H8O4,故A正确;
B.该分子中含有羧基,所以具有酸性,能和NaOH、碳酸氢钠反应,故B正确;
C.该分子中羧基、酯基水解生成的羧基和酚羟基都能与NaOH反应,则1 mol 该化合物与足量的 NaOH溶液反应,消耗 NaOH最大的物质的量为3mol,故C错误;
D.该分子中不含酚羟基,但其水解产物中含有酚羟基,所以该物质不与氯化铁发生显色反应,但其水解产物能和氯化铁溶液发生显色反应,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,把握羧酸、酚、酯的性质即可解答,注意该有机物水解产物中酚羟基能和NaOH反应,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析下列说法,其中正确说法的数目为
①碱性氧化物都是金属氧化物,酸酐都是氧化物
②AlCl3溶液和Al(OH)3胶体的本质区别在于是否有丁达尔效应
③若规定0.024kg12C含有的原子数为阿伏加德罗常数,则标准状况下44gCO2的体积约为44.8L
④标准状况下,气体体积的大小取决于粒子数目和粒子间的平均距离
⑤同温同压下,等质量的二氧化硫气体和二氧化碳气体密度比为16:11,体积比为11:16
⑥把0.05mol氢氧化钡固体加入到100ml 1.0vmol/L盐酸中,溶液导电性基本不变
⑦活泼金属钾、钙、钠、镁、铝均由电解对应的熔融氧化物制得
⑧合金熔点、硬度都低于成分金属,青铜是使用最早的合金,钢是用量最大用途最广的合金
⑨同素异形体:C60、12C、金刚石、石墨
⑩工业合成氨是人工固氮的主要方法,工业生产玻璃、水泥、 冶炼铁都需要用到的原料是石灰石
冶炼铁都需要用到的原料是石灰石
A.3 B.5 C.4 D .7
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难氧化,易加成,难取代 | |
| B. | 能氧化,难加成,易取代 | |
| C. | 易氧化,易加成,难取代 | |
| D. | 因是单双键交替结构,故易加成为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000ωνρ}{36.5}$mol/L | B. | $\frac{1000νρ}{36.5+22400}$mol/L | ||
| C. | $\frac{ων}{22.4(V+1)}$mol/L | D. | $\frac{1000νρ}{36.5V+22400}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢化物的沸点R>X | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:X>Y | |
| D. | X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面对日益严重的环境问题,化学显得无能为力 | |
| B. | 化学的探索空间广阔,可以在能源、资源的合理开发和安全利用方面大显身手 | |
| C. | 化学可以帮助人们攻克一个个医学难题 | |
| D. | 化学是一门具有实用性的科学 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com