
| A. | 未将烧杯和玻璃棒的洗涤液移入容量瓶 | |
| B. | 溶解搅拌时液体飞溅 | |
| C. | 用量筒量取浓盐酸时,仰视读数 | |
| D. | 定容时水加多了,用滴管吸出 |
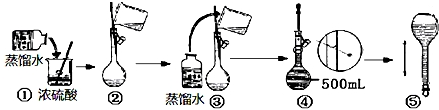
分析 分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:A.未将烧杯和玻璃棒的洗涤液移入容量瓶,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.溶解搅拌时液体飞溅,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.用量筒量取浓盐酸时,仰视读数,导致量取浓盐酸体积偏大,氯化氢溶质的物质的量偏大,溶液浓度偏高,故C选;
D.定容时水加多了,用滴管吸出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故D不选;
故选:C.
点评 本题考查了配制一定物质的量浓度实验误差分析,明确配制原理是解题关键,注意掌握依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+、Cu2+ | Cu2+、Fe3+ | |||
| 残留固体成分 | Fe、Cu | Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
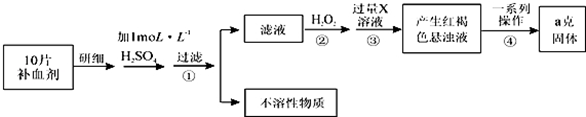
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用托盘天平称量时,所称药品均放在纸上,并置于托盘天平的左盘 | |
| B. | 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| C. | 用最小刻度为0.1mL的量筒量取8.85mL的液体 | |
| D. | 给试管里的液体加热时,试管外壁应干燥,试管口应向上倾斜 | |
| E. | 浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①④⑤ | B. | 仅①②④ | C. | 仅①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大 | |
| B. | 蒸馏时,应使温度计水银球放在蒸馏烧瓶的支管口处 | |
| C. | 盛放NaOH溶液时,可以使用带玻璃瓶塞的磨口瓶 | |
| D. | .用广泛pH试纸测得0.10 mol•L-1 NH4Cl溶液的pH为5.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com