
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12=2Fe3++Br2+4C1- |
分析 A.氢氧化钡过量,反应生成偏铝酸根离子、硫酸钡和一水合氨、水;
B.氢氧化镁为沉淀,应保留化学式;
C.过氧化钠与水反应,过氧化钠既是氧化剂又是还原剂;
D.氯气足量,二价铁离子、溴离子都被氧化.
解答 解:A.铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液,离子方程式:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O,故A正确;
B.用惰性电极电解氯化镁溶液,离子方程式:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓,故B错误;
C.H218O中投入Na2O2固体,离子方程式:2H218O+2Na2O2=4Na++418OH-+O2↑,故C错误;
D.FeBr2溶液中通入足量的氯气,离子方程式:2Fe2++4Br-+3C12=2Fe3++2Br2+6C1-,故D错误;
故选:A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应中保留化学式的物质及电子、电荷守恒,注意反应物用量对反应的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 稀硝酸 | C. | NaOH溶液 | D. | 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
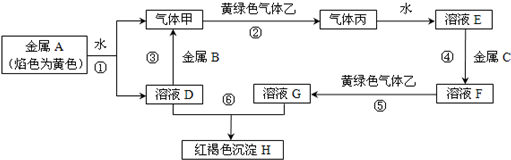
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
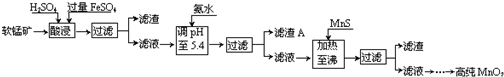
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | HCl溶液 | C. | Na2CO3溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘 遇淀粉变蓝 | B. | 钠 的焰色反应为黄色 | ||
| C. | 矿泉水中含有钙、镁等矿物质 | D. | 磷的同素异形体有红磷、白磷等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | H216O、D216O、H218O、D218O互为同素异形体 | |
| C. | 明矾和漂白粉常用于自来水的净化或杀菌消毒,但两者的作用原理不同 | |
| D. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com