
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
如右图装置,烧杯中盛有饱和食盐水,X、Y是两块石墨电极,两电极通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题:

①该装置最主要的能量转化为_________________
②在X电极附近溶液中可观察到的现象是 X电极上发生_______反应(填“氧化”或“还原”),电极反应式为_____________________。
③检验Y电极上产物的方法是 。
④装置的总反应化学方程式是 。
(1)吸收能量 释放能量 放出 5.5 (2分)(2)①电能转化为化学能
②酚酞试液变红,产生无色气泡; 还原;2H2O +2e- = H2↑+ 2OH- 或2H+ +2e- = H2↑(2分)
③用湿润的淀粉碘化钾试纸检验 ④2NaCl+2H2O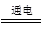 2NaOH+H2↑+Cl2↑ (2分)
2NaOH+H2↑+Cl2↑ (2分)
【解析】(1)从能量的角度看,断开化学键要吸收能量,而形成化学键要放出能量,因此反应热就是断键吸收的能量和形成化学键所放出的能量的差值。所以该反应的反应热是436 kJ/mol+151 kJ/mol-2×299 kJ/mol=-5.5kJ/mol,即该反应是放热反应,放出的能量是5.5kJ。
(2)①根据装置图可知,有外接的电源,所以是电解池,是把电能转化为化学能的。
②X和电源的负极相连,作阴极,溶液中的氢离子放电,发生还原反应生成氢气,方程式为2H+ +2e- = H2↑。由于氢离子放电,破坏了阴极周围水的电离平衡,从而使阴极周围溶液显碱性,因此溶液显红色。
③Y电极和电源的正极相连,作阳极,溶液中的氯离子失去电子,发生氧化反应生成氯气。氯气具有氧化性,可用用湿润的淀粉碘化钾试纸检验。
④根据以上分析可知,总的反应式是2NaCl+2H2O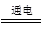 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏南通小海中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。
(2)在生产和生活中经常遇到化学能与电能的相互转化。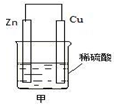
如图甲是将 能转化为 能的装置,负极电极反应式为 ,发生______反应(填“氧化”或“还原”,下同)。正极现象 ,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出 g 氢气。
查看答案和解析>>
科目:高中化学 来源:2010~2011学年浙江省台州市高一下学期期末考试化学 题型:填空题
(12分)I:能源是人类生活和社会发展的基础,地球上最基本的能源是 ▲ ,大自然利用这一能源最成功的是 ▲ 。氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水。)请写出氢气燃烧的热化学方程式 ▲ 。
Ⅱ:理论上任意一个自发的氧化还原反应都能设计成原电池,现有如下反应:
2FeCl3 + Cu = 2FeCl2 + CuCl2
如果将其设计成原电池,请写出负极材料及正极电极反应式。
负极材料: ▲ ;正极电极反应式: ▲ 。
III:工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出工业用电解熔融氧化铝制取铝的化学方程式: ▲ 。
(2)现冶炼2.7 t 铝,需要转移电子的物质的量为 ▲ mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏南通小海中学高一下学期期中考试化学试卷(解析版) 题型:填空题
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
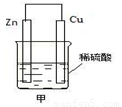
如图甲是将 能转化为 能的装置,负极电极反应式为 ,发生______反应(填“氧化”或“还原”,下同)。正极现象 ,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出 g 氢气。
查看答案和解析>>
科目:高中化学 来源:09-10年大连长海高中高一下学期期末考试化学卷 题型:填空题
(12分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 _ ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 __ (填“放出”或“吸收”) ___ kJ的热量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。已知8g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧热的热化学方程式____________________________________。

(3)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲、乙两装置中,甲中负极电极反应式为_____________________,
溶液中的阳离子向_____极移动(填“正”或“负”);乙中铝电极作__________极,发生______反应(填“氧化”或“还原”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com