
【题目】工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是 。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度下,将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
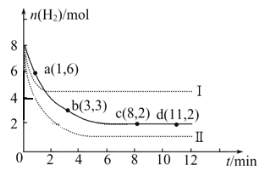
①a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)= 。
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为: 。
【答案】(1)BC;(2)①大于;0.75mol·L-1·min-1;②升温;加压;
(3)CH3OH+ H2O - 6e- = CO2↑+6H+
【解析】
试题分析:(1)n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1,之后浓度可能还在变化,故A不一定达到平衡状态;该反应为反应前后压强可变的反应,压强不变时一定达到平衡状态;H2的消耗速率与CH3OH的消耗速率之比为3∶1可知![]() ,一定达到平衡状态;根据
,一定达到平衡状态;根据![]() ,从开始反应到反应达到平衡,密度不变,密度不随时间变化不能作为平衡标志,故D错误;
,从开始反应到反应达到平衡,密度不变,密度不随时间变化不能作为平衡标志,故D错误;
(2)①a点氢气的量在减少,平衡正向进行,故正反应速率大于逆反应速率;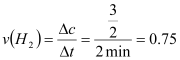 mol·L-1·min-1②曲线I反应速率明显加快,但平衡时氢气的量增大,故实验条件改变是升高温度;曲线II反应速率加快,但平衡时氢气的量减小,故实验条件改变是加压;
mol·L-1·min-1②曲线I反应速率明显加快,但平衡时氢气的量增大,故实验条件改变是升高温度;曲线II反应速率加快,但平衡时氢气的量减小,故实验条件改变是加压;
(3)负极为甲醇失电子发生氧化反应,极反应为CH3OH+ H2O - 6e- = CO2↑+6H+。


科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是
A. N a、Mg、Al原子的失电子能力逐渐减弱
B. Si、P、S元素的最高正化合价依次降低
C. C、N、O的原子半径依次减小
D. Cl、Br、I的气态氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用。
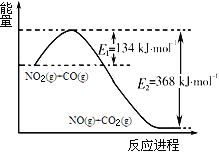
(1)右图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() 其化学平衡常数K与温度t的关系如下表:
其化学平衡常数K与温度t的关系如下表:

完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.![]()
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图1:
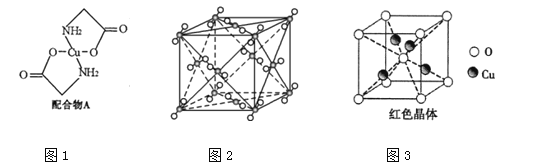
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳,其结构如图2,它属于________晶体,每个CO2分子与________个CO2分子紧邻。写出二氧化碳的一种等电子体: (写化学式)。
(6) 已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图3,则该化合物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理正确的是
盐酸 | 50 mL | 50 mL | 50 mL |
m(混合物) | 9.2 g | 14.2 g | 27.6 g |
V(CO2)(标准状况) | 2.24 L | 3.36 L | 3.36 L |
A.盐酸的物质的量浓度为3.0 mol/L
B.当混合物质量为9.2 g时,50 mL盐酸恰好完全反应
C.混合物中NaHCO3、KHCO3的物质的量之比为1∶2
D.混合物中NaHCO3的质量分数为45.7 %
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖。右图是青蒿素的结构,则有关青蒿素的说法中不正确的是
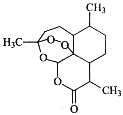
A.有“—O—”键,分子式C15H22O5,可发生取代反应
B.有“六元环”结构,是苯的同系物,可发生加成反应
C.有“—O—O—”键,氧化性较强,可发生还原反应
D.有“—COO—”键,碱性条件下,可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中使用的购物袋的材料多为聚乙烯,下列说法中正确的是
A.用纯净的乙烯合成的聚乙烯是纯净物
B.聚乙烯可以人工合成,也可以是天然高分子化合物
C.聚乙烯能使酸性高锰酸钾溶液褪色
D.聚乙烯的单体能够使溴的四氯化碳溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com