
| A. | 得电子越多,其氧化性越强 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 要完成SO32-→SO42-的转化,必须加入氧化剂 | |
| D. | 金属活动顺序表中,排在前面的金属阳离子的氧化性强于排在后面的金属阳离子 |
分析 A.得电子的多少与氧化性无关;
B.元素化合价为最高价只有氧化性,最低价只有还原性;
C.化合价升高被氧化;
D.金属活动顺序表中,排在前面的金属阳离子的氧化性弱于排在后面的金属阳离子.
解答 解:A.得电子的多少与氧化性无关,应利用得电子的难易程度比较氧化性的强弱,故A错误;
B.元素化合价为最高价只有氧化性,最低价只有还原性,阳离子中元素的化合价处于中间价态时既有氧化性又有还原性,如Fe2+,故B错误;
C.SO32-→SO42-的转化中S元素的化合价升高被氧化,需要加氧化剂,故C正确;
D.金属活动顺序表中,排在前面的金属单质的还原性强,其阳离子的氧化性弱,即排在前面的金属阳离子的氧化性弱于排在后面的金属阳离子,故D错误;
故选C.
点评 本题考查氧化性强弱的判断、氧化还原反应、化合价与物质氧化性和还原性的关系等,题目知识点较多,难度不大,侧重于基础知识的考查.


科目:高中化学 来源: 题型:解答题
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是
Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是| A. | 铜做阳极、石墨做阴极,石墨电极上产生氧气 | |
| B. | 铜电极发生的反应为:2Cu-2e-+2OH-=Cu2O+H2O | |
| C. | 在电解过程中OH-向石墨电极移动 | |
| D. | 当有0.1 mol电子转移时,有0.1 mol Cu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工业中使用催化剂,以提高NH3的产量 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | CO2(g)?CO2(aq)△H<0,降温增压可增大二氧化碳气体在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| C. | 常温常压下,16gO2与16gO3含有的分了数相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,电离平衡右移,所有离子的浓度均降低 | |
| C. | 反应SiO2(s)3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 等体积、等物质的量浓度的NH3•H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3•H2O的电离程度大于NH${\;}_{4}^{+}$的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
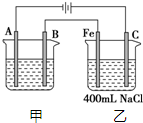 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com