
已知25 ℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol3·L-3。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液的pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中HF与CaCl2反应产生沉淀 D.该体系中没有沉淀产生
科目:高中化学 来源: 题型:
今有A、B、C、D四种元素,其中A元素是1826年法国青年科学家巴拉尔发现的。他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若经进一步提取,可得一种红棕色液体,有刺鼻的臭味。B、C、D的原子电子层排布均不超过3个电子层。D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等。D原子的最内电子层上电子数是B原子核外电子数的2倍。则:
(1)四种元素分别为:A__________;B__________;C__________;D__________。
(2)写出巴拉尔发现A元素单质的离子方程式:_____
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用右图所示的实验装置,
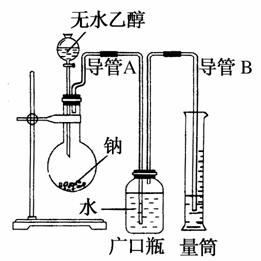
测定乙醇与钠反应(ΔH<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目。试回答下列问题:
(1)指出实验装置的错误______________________________________。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将________(填“偏大”“偏小”或“不变”),原因是____________________________________________。
(3)请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是
A.总反应式都为CH4+2O2 === CO2+2H2O
B.H2SO4和NaOH的物质的量都不变,但浓度都减小
C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O===CO2+4H+
D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-===4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是( )
A.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+) = c(OH-) + c(CH3COO-)
B.对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
C.常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
D.常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:Ka∶Kh=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及氧化变质,在包装袋中应放入的化学物质是
A.无水硫酸铜、蔗糖 B.食盐、硫酸亚铁
C.硅胶、硫酸亚铁 D.生石灰、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中化合物的性质比较,不正确的是( )
A.酸性:H2SO4>H3PO4>H4SiO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
查看答案和解析>>
科目:高中化学 来源: 题型:
能表明NH3·H2O是弱电解质的叙述是( )
A.NH3·H2O的导电性比NaOH溶液弱得多
B.0.1 mol·L-1NH3·H2O的pH大于7
C.(NH4)2SO4的水溶液,其pH小于7
D.5 mL1 mol·L-1的NH3·H2O跟10 mL0.5 mol·L-1的HCl恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com