
【题目】水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe﹣═NaLixV3O8 , 则下列说法不正确的是( ) 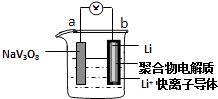
A.放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8
B.充电过程中Li+从阳极向阴极迁移
C.充电过程中阳极的电极反应式为NaLixV3O8﹣xe﹣═NaV3O8+xLi+ , NaLixV3O8中钒的化合价发生变化
D.该电池可以用硫酸钠溶液作电解质
【答案】D
【解析】解:放电时,b电极Li作负极,Li失电子发生氧化反应,电极反应式为Li﹣e﹣═Li+ , a作正极,电极反应式为NaV3O8+xLi++xe﹣=NaLixV3O8 , 则电池反应式为NaV3O8+xLi=NaLixV3O8 , 故A正确;B.充电时,阳离子向阴极移动、阴离子向阳极移动,所以Li+从阳极向阴极迁移,故B正确;
C.充电时,阴极、阳极电极反应式与负极、正极反应式正好相反,所以阳极的电极反应式为NaLixV3O8﹣xe﹣=NaV3O8+xLi+ , NaLixV3O8中Na、O、Li元素化合价不变,则钒的化合价发生变化,失电子发生氧化反应,故C正确;
D.Li极易和水反应生成LiOH和氢气,所以电池中不可以用硫酸钠溶液作电解质溶液,故D错误;
故选D.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在元素周期表中的位置是
A. 第三周期第IA族 B. 第三周期第IIA族
C. 第四周期第VIIA族 D. 第五周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面.NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下:
已知:HCNO的结构式是:H﹣O﹣C≡N
HCN的Ka=6.02×10﹣10
[Ag(CN)2]﹣(aq)Ag+(aq)+2CN﹣(aq) K=1.3×10﹣21
回答下列问题:
(1)CN﹣中两原子均为8电子稳定结构,请写出CN﹣的电子式 .
(2)氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式 .
(3)向发生塔中通水蒸汽的目的是 .
(4)氧化池中氰化物的降解分两步进行,CN﹣被氯气氧化成低毒的CNO﹣ , 写出相应的离子方程式 , CNO﹣被氯气氧化成无毒的两种气体,写出相应的离子方程式
(5)贮水池中废水须先经碱化后再进行氧化的原因 .
(6)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密.电解液使用Na[Ag(CN)2],请写出阴极反应式 , 解释工业电镀中使用氰离子(CN﹣)的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铁皮在发生析氢腐蚀时有0.2mol电子转移,下列说法正确的是( )
A.有5.6 g金属被腐蚀
B.有6.5 g金属被氧化
C.有0.15 mol金属失去电子
D.标准状况下有4.48 L H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生命健康密切相关,“84”消毒液(有效成分为 NaClO)在抗击新冠肺炎疫情中起到重要作用。下列说法错误的是
A.“84”消毒液为混合物
B.“84”消毒液具有漂白性
C.“84”消毒液可用于灭杀新型冠状病毒
D.“84”消毒液可以与“洁厕灵”(主要成分为盐酸)混用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17∶40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y 的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X____________、Y____________、Z____________。
(2)X与Y形成的离子化合物的电子式为 ______________ 。
(3)Y 元素在周期表中的位置为__________,其单质在空气中燃烧产物的电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是 ( )
A. 夏日的傍晚常常看到万丈霞光穿云而过美不胜收
B. 过滤除去氯化钠溶液中的泥沙
C. 食品加工厂利用豆浆中加入盐卤做豆腐
D. 化工厂利用静电除尘技术去除废气中的固体悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________。
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是________________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为____________________。
Ⅱ.为验证氯、溴、碘三种元素的非金属性强弱,用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。

实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液由黄色变为棕红色时,关闭活塞a。
④……
(1)A中发生反应生成氯气,请写出该反应的离子方程式:___________________。
(2)验证氯气的氧化性强于碘的实验现象是________________________。
(3)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________。
(4)为验证溴的氧化性强于碘,过程④的操作和现象是______________________。
(5)过程③实验的目的是____________________。
(6)请运用原子结构理论解释氯、溴、碘非金属性逐渐减弱的原因:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com