
【题目】在1L的密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,1min内,测得υ(A)=1.2mol·L﹣1·min﹣1,则此时容器中B的物质的量是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
科目:高中化学 来源: 题型:
【题目】下列关于化学反应限度的说法中正确的是
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和H2在生产、生活、科技中是重要的燃料。
①2C(s)+O2(g) ===2CO(g) ΔH1=—220 kJ/mol
②
下列推断正确的是
A. C(s)的燃烧热110kJ/mol
B. 2H2(g)+O2(g)===2H2O(g)ΔH1=+480kJ/mol
C. C(s)+H2O(g)===CO(g)+H2(g)ΔH1=+130kJ/mol
D. 欲分解2molH2O(l),至少需要提供4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2、CuCl广泛用于有机合成的催化剂。CuCl2容易潮解; CuCl白色粉末,微溶于水,溶于浓盐酸和氨水生成络合物,不溶于乙醇。
已知:
i.CuCl2+Cu+2HCl(浓)![]() 2H[CuCl2](无色)
2H[CuCl2](无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
ii.副反应:CuCl+H2O![]() CuOH+2HCl;CuCl+Cl—===[CuCl2]—
CuOH+2HCl;CuCl+Cl—===[CuCl2]—
(1)制取CuCl2装置如下:
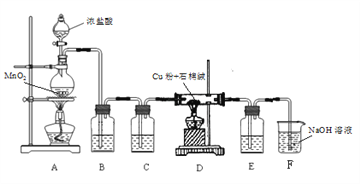
① A装置中发生反应的离子方程式是_________。
② C、E 装置中盛放的是浓硫酸,作用是_________。
③ B中选择饱和食盐水而不用蒸馏水的原因是_________。
(2)制取CuCl流程如下:
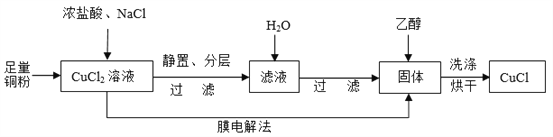
①反应①中加入NaCl的目的是_________;但是Cl—浓度过高,CuCl产率降低,原因是________________。
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为________________。
③利用膜电解法制取CuCl,阴极电极反应式为________________。
④用乙醇洗涤沉淀Y的原因为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯

① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式_____________实验后,检验D溶液中含有CO32-的实验方案为______________。
③ E装置的主要作用是__________________。
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是(_____)
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 油定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的化工产品之一,有着广泛的用途,运用化学反应原理的相关知识研究氨的合成及性质对工业生产有着十分重要意义。
I.合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。

II.恒温下,将一定量N2、H2置于10L的容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。
2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。

(1)图中0~2s内的反应速率v(NH3)=______;该温度下达平衡时N2的转化率为_____。
(2)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)__,平衡常数___。(填编号)
A.增大 B.减小 C.不变 D.不能确定
(3)在不同温度下达到平衡时测得NH3的体积分数如下表所示:
T/℃ | 200 | 300 | 400 |
NH3的体积分数 | a1 | a2 | 38% |
①试比较a1、a2的大小:a1_____a2(填“>”、“<”或“=”)。
②若反应在恒容400℃条件下进行,下列能判断反应达到平衡状态的依据有____ (填编号)。
A.断裂1molH-H键同时断裂2molN-H键 B.v正(N2)=3V逆(H2)
C.容器内N2、H2、NH3;的物质的量之比为1:3:2 D.平衡常数保持不变
E.混合气体的平均相对分子质量保持不变 F.混合气体的密度保持不变
(4)工业上合成氨采用了高温高压、催化剂的条件,根据反应判断下列哪些条件有利于提高氨的产率____。
A.采用400℃~500℃高温 B.采用合适的高压
C.使用铁触媒做催化剂 D.将氨液化从体系中分离出来
(5)氨气制取尿素[CO (NH2)2]的反应:2NH3 (g) +CO2(g) ![]() CO (NH2)2 (1)+H2O (g)。
CO (NH2)2 (1)+H2O (g)。
①该反应温度升高,氨气的百分含量增大,则△H______0(填“>”、“<”或“=”)。
②CO的平衡转化率与温度、压强的关系如图所示, 若充入2mol NH3与1mol CO2在2L密闭容器中进行反应,则100℃时反应的平衡常数K=________;压强的大小关系:P1______P2(填“>”、“<”、“=”或“不确定”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在体积一定的密闭容器中进行如下反应:2X(g)+Y(g) Z(g)+W(s)ΔH>0,下列叙述正确的是
A. 恒温,将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞几率提高
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 在容器中加入氩气,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻尔认为原子核外电子离核越近能量越低。那么,电子从离核无穷远处跃迁到氢离子(H+)的K层所释放的光子在氢原子的发射光谱中对应( )的光子
A. 波长最长 B. 波长最短 C. 平均波长 D. 中间波长
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com