
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如图实验方案和实验装置。(已知SO2能与酸性KMnO4反应生成硫酸盐)

I.探究该合金的某些性质:
(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓H2SO4,A、B中均无明显现象,原因是__;
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出此时合金中成分碳参与的化学反应方程式__;
(3)装置D的作用是__;装置E的作用是__。
II.测定样品中碳的质量分数:
(4)装置F的作用__;
(5)若反应前后E装置的质量分别是m1和m2,则合金中碳的质量分数是__,若没有连接D装置会使测定结果__(填“偏大”“偏小”“无影响”)。
【答案】铁遇浓硫酸钝化,而碳与冷的浓硫酸不反应 ![]() 干燥
干燥![]() 吸收
吸收![]() ,从而确定
,从而确定![]() 的质量 防止空气中的水和
的质量 防止空气中的水和![]() 进入装置E造成影响
进入装置E造成影响 ![]() 偏大
偏大
【解析】
点燃酒精灯后,浓硫酸和碳发生氧化还原反应,得到![]() 和
和![]() 两种气体,B装置的作用是检验
两种气体,B装置的作用是检验![]() 是否存在,而C中的酸性高锰酸钾溶液可以将二氧化硫全部吸收,转变为硫酸盐,接下来D中的浓硫酸将剩下的
是否存在,而C中的酸性高锰酸钾溶液可以将二氧化硫全部吸收,转变为硫酸盐,接下来D中的浓硫酸将剩下的![]() 干燥,得到较纯净的
干燥,得到较纯净的![]() 后再通入E,这样E中的增重就是
后再通入E,这样E中的增重就是![]() 的质量,最后接的装置F可以防止空气中的水和二氧化碳进入装置E,造成测定结果偏大,据此来分析本题即可。
的质量,最后接的装置F可以防止空气中的水和二氧化碳进入装置E,造成测定结果偏大,据此来分析本题即可。
(1)铁遇浓硫酸钝化,不发生反应,而碳和冷的浓硫酸也不反应,因此A、B中均无明显现象;
(2)碳与浓硫酸在加热下反应![]() ;
;
(3)装置D的作用是除去![]() 中水分,使最后装置E中增加的质量就是
中水分,使最后装置E中增加的质量就是![]() 的实际质量,二者缺一不可;
的实际质量,二者缺一不可;
(4)装置F的作用是防止空气中的水和![]() 进入装置E,造成最终测定结果偏大;
进入装置E,造成最终测定结果偏大;
(5)装置E的增重就是![]() 的质量,代入
的质量,代入![]() 的分子量算出其物质的量为
的分子量算出其物质的量为![]() ,而碳元素是守恒的,因此一开始样品中的碳的物质的量也为
,而碳元素是守恒的,因此一开始样品中的碳的物质的量也为![]() ,这些碳的质量为
,这些碳的质量为![]() ,因此合金中碳的质量分数为
,因此合金中碳的质量分数为![]() ;若不连接装置D,会导致测定结果偏大。
;若不连接装置D,会导致测定结果偏大。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】铈Ce)是一种重要的稀土金属元素,常见化合价为+3和+4,在工业上应用广泛。某课题组以回收废旧的电脑显示屏的玻璃粉(含SiO2、CeO2、Fe2O3、和FeO等)为原料,设如下工艺流程回收CeO2,并获得硫酸铁铵晶体[Fe2(SO4)32(NH4)2SO43H2O]
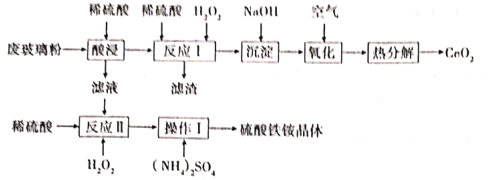
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液;②酸浸时CeO2不反应;③“反应I”所得溶液中含有Ce3+。
试回答下列问题
(1)“滤渣”的化学式为______。
(2)在酸性条件下,H2O2、Fe3+、CeO2三种物质中,氧化性最强的是______;如将稀硫酸改为盐酸,则“酸浸”过程可能产生的大气污染物是______。
(3)“反应Ⅰ”的离子方程式为______。
(4)“氧化”反应的化学方程式为______。
(5)“操作Ⅰ”依次为:低温蒸发结晶、过滤、______常温晾干等操作。所得硫酸铁铵常用作净水剂,在去除酸性废水中的悬浮物时效率降低,原因是______。
(6)科学家利用CeO2在太阳能作用下将H2O、CO2转化成H2、CO,其过程如下:mCeO2![]() (m-x)CeO2xCe+xO2,
(m-x)CeO2xCe+xO2,
(m-x)CeO2xCe+xH2O+xCO![]() mCeO2+xH2+xCO。在该总转化过程中,CeO2作______,从能量转化的角度,该过程的重要意义是______。
mCeO2+xH2+xCO。在该总转化过程中,CeO2作______,从能量转化的角度,该过程的重要意义是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各图均能表示甲烷的分子结构,按要求回答下列问题:

①上述哪一种更能反映其真实存在状况________ (填字母,下同)。
a.Ⅰ b.Ⅱ c.Ⅲ d.Ⅳ
②下列事实能证明甲烷分子是正四面体结构的是_____。
a.CH3Cl只代表一种物质 b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质 d.CCl4只代表一种物质
(2)烃分子中的碳原子与氢原子结合的方式是_____。
a.形成4对共用电子对
b.通过1个共价键
c.通过2个共价键
d.通过离子键和共价键
(3)乙烷的电子式为__________,分子式为CmH20的烷烃中m为________,分子式为C8Hn的烷烃中n为________,与CO2密度(同温同压)相同的烷烃分子式为____,若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是_____。
(4)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.1H2、2H2、3H2互称同位素
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.同一周期(第一周期除外)的元素,从左到右由金属逐渐过渡到非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
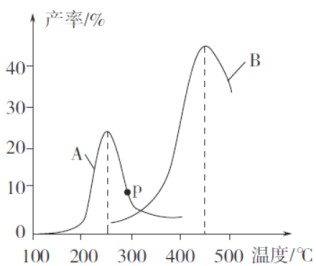
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液或浊液中,关于离子浓度的说法正确的是
A. 一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B. 浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)]
C. 0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+)
D. 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时用0.10mol/L的KOH溶液滴定20.00mL0.10 mol/L的H2C2O4溶液,滴定过程中溶液的pH随KOH溶液体积变化如图所示(忽略滴定过程中溶液的温度变化和体积变化),下列说法错误的是( )
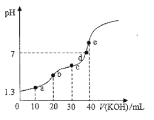
A. 25℃时H2C2O4的电离常数Ka1=10-1.6
B. b点满足关系:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
C. c点溶液中粒子浓度大小顺序:c(K+)>c(C2O42-)>c(HC2O4)>c(H2C2O4)
D. 从a点到e点水的电离程度逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com