
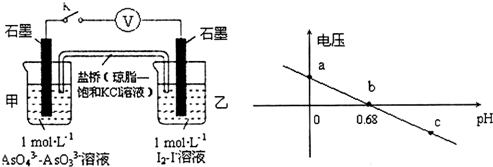
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
分析 A、原电池中阳离子向正极移动;
B、pH=0.68时,电压为零;
C、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子;
D、pH>0.68时,电压小于0,反应逆向进行.
解答 解:A、乙中碘离子失电子,则乙中石墨电极为负极,甲中石墨为正极,原电池中阳离子向正极移动,所以盐桥中K+向左移动,故A正确;
B、pH=0.68时,电压为零,反应处于平衡状态,故B正确;
C、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子,则负极电极反应式为AsO33--2e-+H2O=AsO43-+2H+,故C错误;
D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,故D正确.
故选C.
点评 本题考查了原电池原理的应用和化学平衡移动,侧重于知识的综合应用的考查,难度中等,注意把握题目图象中所给出的信息,考查了学生的读图能力和对基础知识的应用能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀银时,金属银作电解槽的阴极 | |
| B. | 用石墨电极电解硫酸溶液,其实质是电解水,故溶液PH值不变 | |
| C. | 电解法精炼铜时,电解一段时间后,电解液中C(Cu2+)将略有下降 | |
| D. | 为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
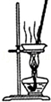 | 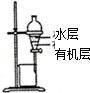 |
| A.装置可用于蒸干氯化铝溶液制AlCl3 | B.装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
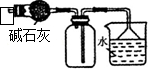 | 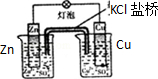 |
| C.装置可用于收集NH3或HCl气体,并防止倒吸 | D.装置盐桥中的K+自右向左移动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量增重了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 | |
| D. | 电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式).Ca2++CO32-=CaCO3↓ |
| 操作2:向2mL NaHCO3溶液中滴加少量的澄清石灰水 | 白色沉淀 | 反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com