
【题目】下列有关物质性质与用途具有对应关系的是
A.二氧化硅为酸性氧化物,可用于制造光导纤维
B.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C.水玻璃具有粘性,可用作粘合剂
D.所有金属都具有焰色反应,可用于烟花的制作
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1的FeCl2溶液中:H+、Al3+、SO42—、ClO
B. 无色透明的溶液中:Al3+、Fe3+、NO3—、SCN—
C. 与Al反应能放H2的溶液中:Cu2+、NH4+、CO32-、Cl
D. c(OH)/c(H+)=1×1014的溶液中:K+、Na+、I、SiO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需用坩埚钳夹取加热后的蒸发皿
B. 容量瓶使用前无需检漏
C. 蒸馏实验结束后,先停止通冷凝水,再停止加热
D. 焰色实验所用的铂丝,每次用完后都要用稀硫酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉加入到盛有FeCl3、FeCl2、CuCl2的混合液的烧杯中,判断下列情况烧杯中的固体及金属阳离子(用化学式表示):
(1)若反应后铁粉有剩余,则一定有______________。
(2)若反应后有Cu2+和Cu,则不可能有_________。
(3)若反应后有Cu2+和Fe3+,则一定有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,等物质的量的SO2与SO3相比较,下列结论中不正确的是
A. 分子数之比为1∶1 B. 原子总数之比为3∶4
C. 质量之比为4∶5 D. 密度之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为____________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
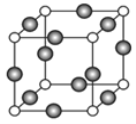
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质制备的说法正确的是
A. 电解饱和食盐水可以得到金属钠、氢气和氯气
B. 工业上将氯气通入澄清石灰水中制取漂白粉
C. 用焦炭在高温下还原二氧化硅可得到粗硅
D. 高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2-都能与MnO4—反应生成NO3-。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:
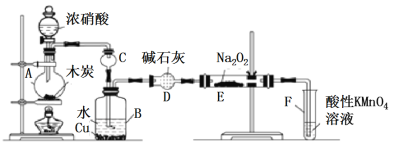
(1)A中反应的化学方程式_____________;
(2)装置B中观察到的主要现象______________;
(3)仪器D的名称是___________________;
(4)A中滴入浓硝酸之前,应先通入N2一段时间,原因是____________;
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________;
(6)若无装置D,则E中产物除NaNO2外,还有_______(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
步骤1:提出假设
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
步骤2:设计实验
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解, ①__________________________________________ | ②___________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com