
2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO↑+5CO2↑元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl= 4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式 ls22s22p63s23p63d6或[Ar]3d6 ;
②羟胺中(NH2OH)采用sp3杂化的原子有N、O ,三种元素电负性由大到小的顺
序为 ;
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为 6 ;
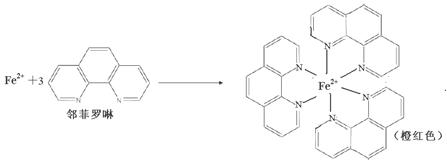
④N2O分子的空间构型为 (用文字描述)。
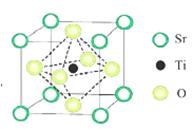 (2)分子氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可
(2)分子氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可
分解水制取H2同时获得O2。已知钛酸锶晶胞结构如
图所示,则钛酸锶的化学式为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+ xCO2 mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
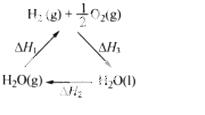 下列说法不正确的是
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO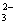 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol铁,充分反应后产生的NO气体在标准状况下的体积为( )
|
| A. | 36L | B. | 22.4L | C. | 28L | D. | 11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解
B.向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液,试管口出现红棕色气体, 说明溶液中NO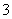 被Fe2+还原为NO2
被Fe2+还原为NO2
C.将某气体通入品红溶液中,品红褪色,说明该气体一定是SO2
D.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
 (2)NaClO3的作用是 。
(2)NaClO3的作用是 。
(3)加Na2CO3调pH至5.2所得沉淀为
。
(4)萃取剂对金属离子的萃取率与pH的关系如图。
萃取剂的作用是 ;
其使用的较适宜pH范围是 。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质
量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ/mol,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.增大压强同时加催化剂
B.降低温度
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
将1L 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5L 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a+2b) kJ B.(4b-10a) kJ C.(5a-2b) kJ D.(10a+4b) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合溶液中,加入过量的氨水产生沉淀,再加入过量的氢氧化钠溶液,沉淀消失的是( )
A.NaCl和MgCl2 B.NaNO3和KNO3
C.K2SO4和Al2(SO4)3 D.MgCl2和AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
烧瓶中放入铜片和稀硝酸,来制取较纯净的一氧化氮,反应开始后发现烧瓶中出现红棕色气体,这时的操作应是( )
A.立即接上收集容器,用向上排空气法收集
B.待烧瓶中红棕色气体消失后,用向上排空气法收集
C.待烧瓶中红棕色气体消失后,用排水法收集
D.立即用排水法收集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com