
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
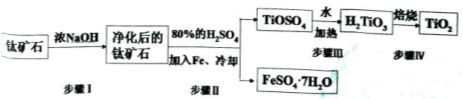
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
(1)除去Al2O3和SiO2 (2)FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(3) 蒸发浓缩、冷却结晶 MnO2 + 2Fe2+ + 4H+ == Mn2+ + 2Fe3+ + 2H2O
(4)溶液中存在平衡:TiO2++2H2O H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。
H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。
(5)当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点,1.50mol/L
【解析】
试题分析:(l)在钛矿石中含有的Al2O3和SiO2能够与NaOH发生反应变为容易溶于水的物质。因此步骤I的目的是除去Al2O3和SiO2。(2)步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式是FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;(3)由于FeSO4的溶解度受温度的影响变化较大,所以从溶液中获得晶体的操作步骤II中经过蒸发浓缩、冷却结晶、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体。Fe2+有还原性,MnO2有氧化性,在酸性条件下发生氧化还原反应。该反应的两种方程式是MnO2 + 2Fe2+ + 4H+ =Mn2+ + 2Fe3+ + 2H2O;(4) 在溶液中存在水解平衡:TiO2++2H2O H2TiO3+2H+,水解反应是吸热反应。当加入热水升高温度后,促进盐的水解,水解平衡正向移动,会生成更多的H2TiO3,从而促使物质的转化。(5)①在原来的溶液中含有Fe3+,以以KSCN溶液为指示剂,此时溶液是红色,其中存在平衡:Fe3++3SCN-
H2TiO3+2H+,水解反应是吸热反应。当加入热水升高温度后,促进盐的水解,水解平衡正向移动,会生成更多的H2TiO3,从而促使物质的转化。(5)①在原来的溶液中含有Fe3+,以以KSCN溶液为指示剂,此时溶液是红色,其中存在平衡:Fe3++3SCN- Fe(SCN)3.随着铝粉的不断加入,c(Fe3+)不断降低,平衡逆向移动,红色逐渐变浅,当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点;②根据电子转移数目相等可得关系式:3TiO2+~Al~3Fe3+.n(Fe3+)=0.1mol/L×0.03L×5=0.015mol. n(TiO2+)= 0.015mol, 所以待测钛液中TiOSO4的物质的量浓度是c(TiO2+)= 0.015mol÷0.01L=1.50mol/L.
Fe(SCN)3.随着铝粉的不断加入,c(Fe3+)不断降低,平衡逆向移动,红色逐渐变浅,当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点;②根据电子转移数目相等可得关系式:3TiO2+~Al~3Fe3+.n(Fe3+)=0.1mol/L×0.03L×5=0.015mol. n(TiO2+)= 0.015mol, 所以待测钛液中TiOSO4的物质的量浓度是c(TiO2+)= 0.015mol÷0.01L=1.50mol/L.
考点:考查实验操作的目的、混合物的分离、盐的水解、滴定终点的判断及物质的浓度的计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:选择题
下列关于有机化合物的叙述错误的是
A.甲烷和乙烯可以用溴水鉴别
B.煤油是石油的分馏产品,可用于保存少量的钠
C.棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质
D.用饱和碳酸钠溶液可除去乙酸乙酯中混有的乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:选择题
下列实验设计能够成功的是
| 实验目的 | 实验步骤及现象 |
A | 检验亚硫酸钠试样是否变质 |
|
B | 检验某盐是否为铵盐 |
|
C | 证明酸性条件H2O2氧化性比I2强 |
|
D | 除去氯化钠晶体中少量硝酸钾 |
|
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:实验题
(16分)某化学兴趣小组在进行钠在空气中燃烧的实验,请写出钠在氧气中燃烧的化学方程式: 。实验后,同学们发现除了得到黄色物质外,产物中还有黑色物质。兴趣小组的同学对产生的黑色固体物质进行实验探究。
查阅资料:
工业上采用铁环作阴极电解得到金属钠。实验室中金属钠的标签主要内容如下:
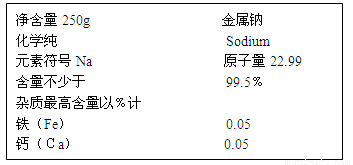
提出猜想:
猜想1:钠附着煤油,煤油的不完全燃烧可以生成碳单质;猜想2: 与钠反应也可以生成碳单质;
猜想3: ; 猜想4:……
设计实验方案,验证猜想:
实验目的 | 实验步骤 | 实验现象 | 结论 |
验证猜想1 | 将一小块钠从煤油中直接取出加热燃烧 取出一小块切去表皮并擦干净煤油的钠加热燃烧 |
| 黑色物质中含 有碳单质 |
验证猜想3 |
|
| 黑色物质中 含有铁元素 |
思考与交流:
同学们了解到金属钠在石棉网上燃烧,与石棉网作用也可以生成含铁的黑色物质,请你评价钠在石棉网上燃烧探究其在空气中燃烧产物是否合理并说明原因: 。
请设计实验验证猜想2(不要求写具体操作过程): 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
下列叙述的实验能达到预期目的的是 ( )
选项 | 实验内容 | 实验目 |
A | 滴定实验中,用待测液润洗锥形瓶2~3次 | 避免造成实验误差 |
B | 向氯水滴加AgNO3、稀HNO3溶液,产生白色沉淀 | 验证氯水中含有Cl- |
C | 向盛有沸水的烧杯中滴加饱和氯化铁溶液并长时间煮沸 | 制备氢氧化铁胶体 |
D | 向2mL 1mol· L-1 NaOH溶液中先加入3滴1mol· L-1 MgCl2溶液,再加入3滴1mol· L-1 FeCl3溶液 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:选择题
一种太阳能电池的工作原理示意图如下所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
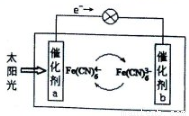
A.K+移向催化剂b B.催化剂a表面发生反应:Fe(CN)64――e-=Fe(CN)63-
C.Fe(CN)63-在催化剂b表面被氧化 D.电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的铁粉加入稀硝酸中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe2+ |
B | AlCl3溶液中滴加过量的氨水溶液 | 先出现白色沉淀,后沉淀又逐渐溶解 | 氢氧化铝能溶于氨水 |
C | 铝箔插入稀硝酸中 | 无明显现象 | 铝箔表面被稀硝酸氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓硫酸点到pH试纸上 | 试纸变黑色 | 浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
下列气体中,不能用排空气法收集的是( )
A.NH3 B.NO C.NO2 D.SO2
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
根据元素周期律和物质结构的有关知识,以下有关排序错误的是
A.离子半径:S2->Cl->Ca2+ B.原子半径:Ca>S>Cl
C.热稳定性:HCl>H2S>H2Se D.酸性:HClO4<HBrO4<HIO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com