
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中NaClO 是氧化剂 |
| C.反应②的产物K2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应①为氧化还原反应,反应②为复分解反应 | B、反应①中氧化产物与还原产物物质的量之比为2:9 | C、反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
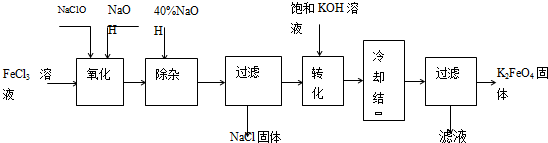
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图
(1)“氧化”过程中的氧化剂是 (填化学式)。比较NaClO、Na2FeO4的氧化性强弱(填<、=、>) 。
“除杂”除去的是 。
(2)“转化”过程中发生的化学反应方程式为 ,与我们见过的分离 混合物的原理相似。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后 。
方法Ⅱ:电解法。
(4)以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入 。
查看答案和解析>>
科目:高中化学 来源:2011届广东省湛江一中高三上学期10月份月考(理综)化学卷 题型:填空题
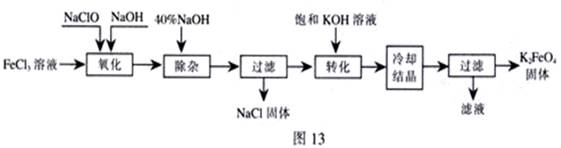
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图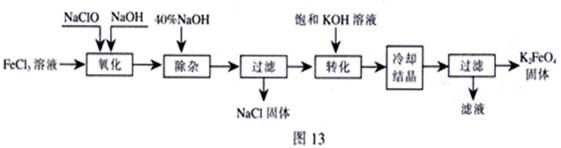
(1)“氧化”过程中的氧化剂是 (填化学式)。比较NaClO、Na2FeO4的氧化性强弱(填<、=、>) 。
“除杂”除去的是 。
(2)“转化”过程中发生的化学反应方程式为 ,与我们见过的分离 混合物的原理相似。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后 。
方法Ⅱ:电解法。
(4)以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com