
【题目】下列有关SO2的性质的探究实验报告记录的实验现象正确的是
实验 |
| ||||
记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】稀土元素包括钪、亿和系共17种元素,是重要的战略资源,我国稀土资源丰富。从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的一种工艺流程如图:
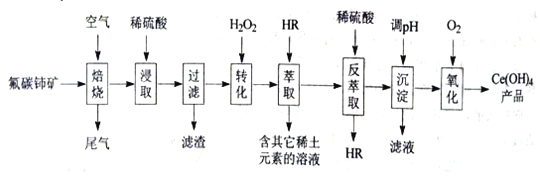
已知:①焙烧后铈元素主要以CeO2形式存在,Ce(
OH)3的Ksp=10×10-20
②Ce4+能与SO42-结合成[CeSO4]2+,Ce3+能被萃取剂HR萃取
(1)为提高原料的利用率,焙烧前应将矿石____处理。
(2)“浸取”过程中铈元素发生反应的离子方程式为___。
(3)“转化”过程中H2O2的作用是___。
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是___;HR应该具有的特点是____。
a.萃取剂HR的密度一定比水大
b.萃取剂HR不溶于水,也不和水反应
c.萃取剂HR和Ce3+不反应
d.Ce3+在萃取剂中溶解度大于水中
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),溶液的pH应大于___。
(6)“氧化”操作得到产品的化学方程式为____。
(7)CeO2是汽车尾气净化器中的关键催化剂,能在还原性气氛中供氧,在氧化性气氛中耗氧,过程为:2CeO22CeO2-x+xO2↑(0≤x≤0.5)。写出CeO2消除CO的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、Z-、W2四种离子均具有相同的电子层结构
、Z-、W2四种离子均具有相同的电子层结构![]() 下列关于X、Y、Z、W四种元素的描述,不正确的是
下列关于X、Y、Z、W四种元素的描述,不正确的是![]()
![]()
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y>W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.235g核素![]() U发生裂变反应:
U发生裂变反应:![]() +
+![]()
![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
B.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
C.中子数为146、质子数为92的铀(U)原子:![]() U
U
D.![]() U和
U和![]() U是中子数不同,质子数相同的同种核素
U是中子数不同,质子数相同的同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
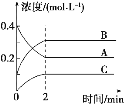
A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟内A的平均速率为____________。
(2)在实验2中,A的初始浓度=_____,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是____。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3______v1(填“>”、“=”或“<”),且C3___1.0mol/L(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是____反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是a~p十一种元素在周期表中的位置,请回答下列问题:
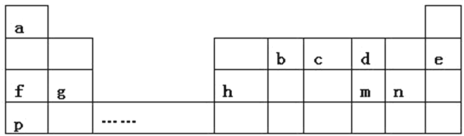
(1)m的阴离子结构示意图为________
(2)d元素在周期表中的位置为________
(3)b的最高价氧化物的结构式为________
(4)d、g、n形成的简单离子的半径由大到小的顺序为________(用离子符号填写)。
(5)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为________(填化学式)。
(6)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为________
(7)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为________
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
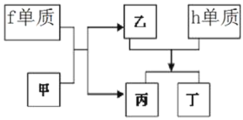
①丁属于________(选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的离子方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国由海水提取的食盐(海盐)不足四成,大部分产自内陆盐湖(湖盐)和盐矿(矿盐)。
(1)由内陆盐湖水为原料进行晒盐,有“夏天采盐(食盐)、冬天捞硝(芒硝)”的说法,下列对其化学原理的描述正确的是___(选填编号)。
a.由夏到冬,芒硝的溶解度变小
b.由冬到夏,氯化钠的溶解度变小
c.夏天温度高,氯化钠易结晶析出
(2)芒硝型矿盐卤水中含有一定量Na2SO4和少量Ca2+、Mg2+、H2S等杂质,利用硫酸钙微溶于水的性质,用石灰-烟道气(CO2)法净化芒硝型矿盐卤水的流程如图:
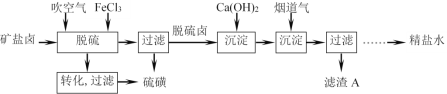
脱硫工序中先吹空气,发生物理和化学变化:物理变化是氢硫酸有挥发性,部分被直接吹出,化学变化是___(用化学方程式表示)。再加入稍过量的FeCl3溶液除去残留的硫化氢。检验FeCl3已经过量的试剂是___(填写化学式)。
(3)加入Ca(OH)2能降低芒硝浓度并生成烧碱,同时除去Fe3+,另一目的是___。滤渣A的主要成分除了Fe(OH)3外,还有___(填写化学式)。
(4)如图所示是石灰-纯碱法净化芒硝型矿盐卤水的部分流程:加入纯碱的作用是___(选填编号)。
a.调节溶液的pH b.除去溶液中的Ca2+
c.除去溶液中的Mg2+ d.除去溶液中的SO42―
石灰-烟道气法与石灰-纯碱法相比较,石灰-烟道气法的优点是___。

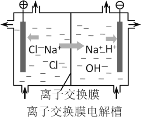
(5)如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需要进行二次精制后才能作为离子交换膜电解槽的原料。对盐水进行二次精制的目的是___(选填编号)。
a.进一步降低Ca2+、Mg2+的浓度,提高烧碱纯度
b.进一步降低SO42―的浓度,提高烧碱纯度
c.防止杂质离子与碱生成的沉淀堵塞离子交换膜
d.防止溶液酸性或碱性过强,腐蚀离子交换膜
盐水中硫酸根浓度过高会使生成的氯气中混有氧气,检验氯气中是否含有少量氧气的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ①③⑥B. ③⑤⑥C. ①④⑤D. ③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com