
按下图电解NaCl的饱和溶液,写出该电解池中发生反应的总反应方程式:________。

将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是________。
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
已知2SO2+O2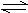 2SO3是一个正反应放热的可逆反应。如果反应在密闭容器中进行,则下列有关途述正确的是
2SO3是一个正反应放热的可逆反应。如果反应在密闭容器中进行,则下列有关途述正确的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.升高温度可加快逆反应速率但不能改变正反应速率
C.一定条件下,SO2可100%转化为SO3
D.任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________________________________________________________________________。
(2)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
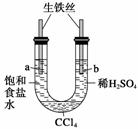
下列与金属腐蚀有关的说法正确的是 ( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
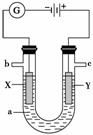
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是_______________________________________,
在X极附近观察到的现象是______________________________________________。
②Y电极上的电极反应式是_________ _____________________________________,
_____________________________________,
检验该电极反应产物的方法是_____________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_______________________________________________________,
电极反应式是__________________________________________________________。
②Y电极的材料是______________________________________________________,
电极反应式是___________________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重_____________________________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
齐齐哈尔第二制药厂曾用有毒的二甘醇代替医用丙二醇(HOCH2CH2CH2OH)做某种注射药液的辅料,酿成了轰动一时的“齐二药”事件。下列关于丙二醇的说法正确的是( )
A.丙二醇不易溶于水 B.1mol丙二醇和足量钠反应生成1mol H2
C.可由丙烯加成Br2后水解制备 D.丙二醇俗称甘油,有护肤作用
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
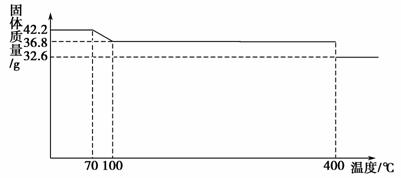
试回答下列问题:
(1) 试确定150 ℃时固体物质的化学式_________________________________
_________ ______________
______________ __________________________________________。
__________________________________________。
(2) 查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_______________________________________________________________________________________
________________________________________________________________。
(3) 在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=__________________________________________
________________________________________________________________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+ O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为________________________________________________________________________。
O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为________________________________________________________________________。
上述转化的重要意义在于___________________________________________
________________________________________________________________。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全____________________________________________________________________________________________________________________________________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com