
| �� ���� | IA | | 0 | |||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | | | | �� | �� | �� | | |
| 3 | �� | | �� | | �� | �� | �� | |


 ��H2O2��2H����2Fe
��H2O2��2H����2Fe ��2H2O����1����2��1������ÿС��2�֣�
��2H2O����1����2��1������ÿС��2�֣� ��
�� ��
�� ��H2O2��2H����2Fe
��H2O2��2H����2Fe ��2H2O��
��2H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 )���±���ʾ��
)���±���ʾ��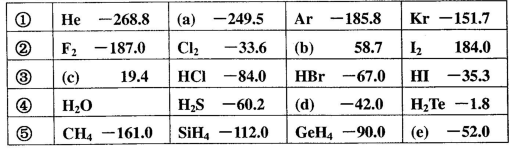
A��a��b��c�Ļ�ѧʽ�ֱ�Ϊ �� �� �� �� |
| B���ڢ������ʾ��������ԣ��ڢ������ʶ�Ӧˮ��Һ����ǿ�� |
C���ڢ����и���������ȶ���˳��Ϊ�� |
| D���ϱ���ͬ�����ʶ�Ӧ���⻯��ķе㣬������Է������������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 1 | A | | | | | | | |
| 2 | | | | B | C | D | | |
| 3 | E | | | | | F | G | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ԭ�ӵ���������������ӵ�Ԫ�ض��ڵڢ�A�� |
| B��Ԫ����������Ԫ��ԭ�Ӻ�������Ų������Ա仯�Ľ�� |
| C����A��Ԫ�ض��ǽ���Ԫ�� |
| D�������ԭ���У�����˽Ͻ����������˶��ĵ��������ϸ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
| T | M���ϵ�������K���ϵ�������3�� |
| X | �����������Ǵ�����������2�� |
| Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
| Z | Ԫ����������ǣ�7�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| A�������к����Թ��ۼ� | B������1���Ҽ���2���м� |
| C�����ڷǼ��Է��� | D���û���������У���ԭ�Ӳ���sp2�ӻ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com