
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
科目:高中化学 来源:不详 题型:单选题
| A.H + H =" H—H" |
| B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ |
| D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热化学方程式中标注的“±a kJ·mol—1” |
| B.特指1mol反应物燃烧时放出的热量 |
| C.不论多少物质反应放出的热量都是反应热 |
| D.专指化学反应过程中放出的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ②稀溶液中,
②稀溶液中,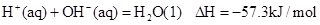 ,下列结论正确的是:
,下列结论正确的是:| A.碳的燃烧热大于110.5kJ/mol |
| B.①的反应热为221kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为△H=57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
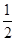 O2(g)=CO2(g) △H= —283kJ/mol
O2(g)=CO2(g) △H= —283kJ/mol H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=  H2(g)+CO2(g)下列能判断该反应达到化学平衡状态的是 (填字母)。
H2(g)+CO2(g)下列能判断该反应达到化学平衡状态的是 (填字母)。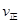 (CO)=
(CO)=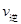 (H2O) d.c(CO)=c(H2)
(H2O) d.c(CO)=c(H2)  H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
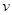 (CO2)表示的反应速率为 。
(CO2)表示的反应速率为 。 CH3OH(g)+H2O(g),右图表示
CH3OH(g)+H2O(g),右图表示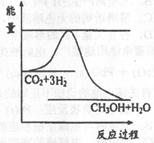

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
| C.由C(石墨)= C(金刚石);△H=" +1.90" kJ/mol可知,金刚石比石墨稳定 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.②③④ | C.④ | D.①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com