
【题目】化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是 ( )
选项 | 现象或事实 | 解释 |
A | Na2O2常用于潜水艇或呼吸面具的供氧剂 | Na2O2与H2O、CO2反应产生O2 |
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C | FeCl3溶液可用于刻制印刷铜电路板 | FeCl3可与Cu发生反应 |
D | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | 烧菜时铁锅被染色 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】如图是盛放液溴的试剂瓶剖面图,仔细观察分成了明显的气相、溴溶液相和液溴相三相,下列说法错误的是( )

A.气相呈现红棕色,因为其中含有Br2的蒸汽
B.溴溶液相中显酸性,主要因为HBr电离出了H![]()
C.液溴保存时加水形成水封的目的是减少Br2的挥发
D.液溴保存时不可敞口放置,应保存在细口瓶中并塞上橡胶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 4.0×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:_____。
(4)OH-浓度相同的等体积的两份溶液HCl(A)和 CH3COOH(E),分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_______(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
(5)向 0.l molL-1 CH3COOH溶液中滴加 NaOH 溶液至c(CH3COOH) : c(CH3COO-) =2 : 36,此时溶液pH = __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式______________,其最外层有____种不同运动状态的电子。
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:_____________________________________________________。
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平____________________。
②上述反应中,若转移了3mol电子,得到的还原产物是__________mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式________。
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是________________晶体,Ni(CO)4易溶于下列_______(填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中一定不符合条件的是
A. CH4、C2H4B. C2H2、C3H6C. C3H4、C2H4D. CH4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体②液态HCl③CO2 ④汞⑤CaCO3固体⑥稀硫酸⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水,其中属于电解质的是(填序号,下同)___________;属于非电解质的是____________;能导电的有__________。
(2)已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br。在含有 FeI2和 FeBr2的溶液中通入少量 Cl2,则最先被氧化的离子是_____,I、Br、Fe2+还原性由强到弱的顺序为:___________。
(3)实验室里盛装NaOH溶液试剂瓶用橡皮塞或软木塞,而不用玻璃塞。用化学方程式解释:_________________________________________________
(4) 0.3mol氨气和0.4mol二氧化碳的质量之比___________,所含分子数之比______________,所含原子数之比____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
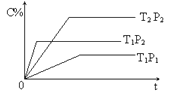
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。

(装置分析)
(1)装置①中反应的离子方程式是____________________________。
(2)装置②中的试剂是________(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
(3)装置③中的试剂是__________。
(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是_____________。
(5)过氧化钠跟二氧化碳反应的化学方程式是______________________。
(实验反思)
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是______。
(7)需要补充的实验操作是:取⑤中反应后的少量固体,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写及其反应类型都正确的是( )
A. ![]()
![]()
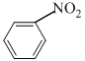 取代反应
取代反应
B. 2CH3CHO+O2![]() 2CH3COOH 氧化反应
2CH3COOH 氧化反应
C. CH2=CH2+Br2 → CH3CHBr2 加成反应
D. HCOOH+CH3CH2OH ![]() HCOOCH3CH2+H2O 酯化反应
HCOOCH3CH2+H2O 酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com