
分析 (1)纯碱比大理石成本高,不经济;反应速率太快,难于控制和收集;
(2)①由题目信息可知:Fe2+、Cr2O72-在酸性条件下反应生成Fe3+、Cr3+、H2O,配平书写离子方程式;
②锡与盐酸发生反应:Sn+2HCl═SnCl2+H2↑,加入过量的FeCl3溶液,发生的反应为:SnCl2+2FeCl3═SnCl4+2FeCl2,滴定时发生反应:6 Fe2++Cr2O72-+14 H+═6 Fe3++2 Cr3++7 H2O,根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,根据n=cV计算反应中消耗的K2Cr2O7的物质的量,根据关系式计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:(1)纯碱比大理石成本高,不经济;反应速率太快,难于控制和收集,实验室常用大理石与稀盐酸反应制取CO2,不用纯碱与盐酸或硫酸反应制取CO2,
故答案为:纯碱比大理石成本高,不经济;反应速率太快,难于控制和收集;
(2)①由题目信息可知:Fe2+、Cr2O72-在酸性条件下反应生成Fe3+、Cr3+、H2O,配平后反应离子方程式为:6 Fe2++Cr2O72-+14 H+═6 Fe3++2 Cr3++7 H2O,
故答案为:6 Fe2++Cr2O72-+14 H+═6 Fe3++2 Cr3++7 H2O;
②锡与盐酸发生反应:Sn+2HCl═SnCl2+H2↑,加入过量的FeCl3溶液,发生的反应为:SnCl2+2FeCl3═SnCl4+2FeCl2,滴定时发生反应:6 Fe2++Cr2O72-+14 H+═6 Fe3++2 Cr3++7 H2O,根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
反应中消耗的K2Cr2O7的物质的量为0.200mol/L×0.0150L=3×10-3mol,
故n(Sn)=3n(K2Cr2O7)=3×3×10-3mol=9×10-3mol,
Sn的质量为:9×10-3mol×119g/mol=1.071,
试样中Sn的百分含量为$\frac{1.071g}{1.2g}$×100%=89.3%,
故答案为:89.3%.
点评 本题考查氧化还原反应滴定的计算、二氧化碳之比等,难度中等,注意利用关系式计算的计算.


科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入15mol H2和0.5mol N2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应时失去的电子数为0.1NA | |
| C. | 0.1L的0.1mol•L-1 Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物一定含有氧元素 | B. | 该有机物一定不含氧元素 | ||
| C. | 该有机物一定是甲烷 | D. | 该有机物可能是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | |
| B. | FeCl3溶液用于铜质印刷线路板制作 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 84消毒液用于环境消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
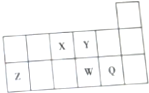
| A. | X的最高价氧化物对应水化物能与它的氢化物反应 | |
| B. | Y原子的电子总数是其K层电子数的3倍 | |
| C. | Z的氧化物能溶于氢氧化钠溶液 | |
| D. | Q的单质能与W的氢化物发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C中官能团的名称是醛基;
,C中官能团的名称是醛基; ;
; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可以加快反应速率 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 合成氨反应的限度可以随着条件的改变而改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com