
| | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

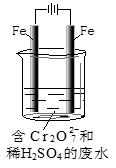
 Al(OH)3+3H+(2分,化学式、系数各1分)
Al(OH)3+3H+(2分,化学式、系数各1分) Al(OH)3+3H+ 。
Al(OH)3+3H+ 。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
| B.制铝:工业上电解氯化铝来制备铝 |
| C.制钠:电解饱和NaCl溶液 |
| D.炼铁:用CO在高温下还原铁矿石中的铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
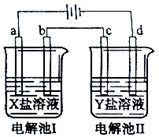
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电解时H+从I区通过离子交换膜迁移到II区 |
| B.Ag-Pt电极上发生发应:2 NO3-+10e-+6H2O= N2↑+12OH- |
| C.当电解过程中转移了1moL电子,则II区电解液质量减少2.8g |
| D.为增强溶液的导电性,I区水中可加入少量Na2SO4固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1 |
| B.在两个阳极上得到的产物的物质的量不相等 |
| C.硝酸亚汞的化学式为HgNO3 |
| D.硝酸亚汞的化学式为Hg2(NO3)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 等离子,电极为惰性电极。下列叙述中正确的是
等离子,电极为惰性电极。下列叙述中正确的是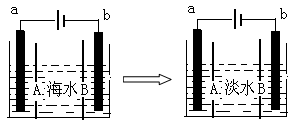
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
| D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
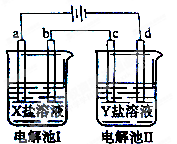
| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | AgNO3 | Pb(NO3)2 |
| C | FeSO4 | Al2 (SO4)3 |
| D | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.光催化还原水制氢比电解水制氢更节能环保、更经济 |
| B.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 |
| C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol·L-1的目标分子 |
| D.向汽油中添加甲醇后,该混合燃料的热值不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com