
| A. | 第2min时,c(Fe2+)=0.01 mol•L-1 | |
| B. | 混合溶液中,c(K+)=0.01 mol•L-1 | |
| C. | 0~2min内,v(I-)=0.01 mol•L-1•min-1 | |
| D. | 第2min时,c(Fe3+)=0.01 mol•L-1 |
分析 A.根据离子方程式结合c(I-)计算;
B.钾离子不参加反应,根据c(K+)=$\frac{n({K}^{+})}{V(总)}$计算;
C.根据v=$\frac{△c}{t}$计算;
D.用Fe3+的起始浓度减去消耗的浓度即可求出.
解答 解:A.2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(s)生成的c(Fe2+)等于参加反应的c(I-),所以c(Fe2+)=c(I-)减少=$\frac{0.1×4}{5}$-0.04=0.01mol/L,故A正确;
B.钾离子不参加反应,c(K+)=$\frac{n({K}^{+})}{V(总)}$=$\frac{0.1×4}{5}$=0.08molL,故B错误;
C.c(I-)减少=$\frac{0.1×4}{5}$-0.04=0.01mol/L,则v=$\frac{△c}{t}$=$\frac{0.01mol/L}{2min}$=0.005mol•L-1•min-1,故C错误;
D.第2min时,c(Fe3+)=$\frac{1L×0.25mol/L-0.01mol/L×5L}{5L}$=0.04mol/L,故D错误.
故选A.
点评 本题考查了离子方程式的有关计算、反应速率的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握溶液中发生的反应以及速率的计算公式.


科目:高中化学 来源: 题型:填空题
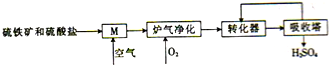 煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.
煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) | |
| B. | 等物质的量浓度的氨水和H2C204溶液等体积混合,所得溶液呈碱性 | |
| C. | pH=11的氨水和pH=3的H2C204溶液等体积混合,所得溶液呈酸性 | |
| D. | 用H2C204溶液中和氨水至中性时,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做过木炭还原氧化铜实验的硬质玻璃管(盐酸) | |
| B. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| C. | 做过碘升华实验的试管(酒精) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液pH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中pH值增大,有O2放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com