
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
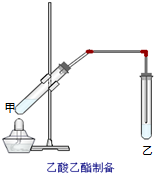 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制450mL溶液需要用到450mL容量瓶 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上 | |
| D. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
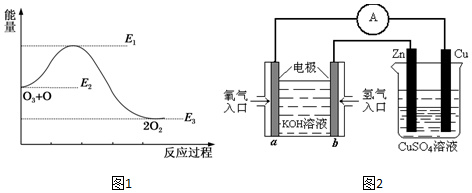
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大的顺序为r(X)<r(Y)<r(Z)<r(W) | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | Z分别能与X、Y和W形成多种化合物 | |
| D. | 与单质W比较,单质Z更容易与单质X化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
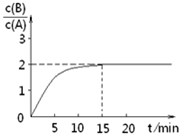 某温度下在2L密闭容器中加人一定量A,发生以下化学反应:
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为4mol | |
| C. | 反应到达平衡时,放出的热量是193kJ | |
| D. | 15min时,v正=v逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
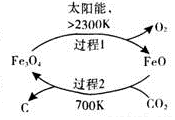 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.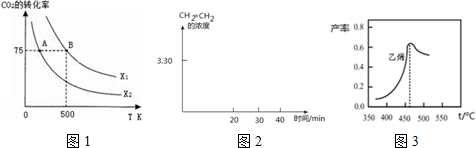
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com