
| A. | 无论在什么条件下,c(H+)增大,酸性都增强 | |
| B. | 稀释氯化铵溶液,水的电离程度变大 | |
| C. | 稀释氢氧化钠溶液,水的电离程度变小 | |
| D. | 升高温度,KW变大,H+浓度增大 |
分析 A.c(H+)增大,酸性不一定增强;
B.NH4Cl溶液,加蒸馏水稀释,其浓度减小,对水的电离的促进程度减小;
C.稀释氢氧化钠溶液,c(NaOH)减小,碱的浓度越大水的电离程度越小;
D.水的电离是吸热反应,升高温度促进水电离.
解答 解:A.c(H+)增大,酸性不一定增强,升高温度促进纯水电离,溶液中c(H+)增大但溶液仍然呈中性,故A错误;
B.NH4Cl溶液,加蒸馏水稀释,其浓度减小,对水的电离的促进程度减小,所以水的电离程度减小,故B错误;
C.稀释氢氧化钠溶液,c(NaOH)减小,碱的浓度越大水的电离程度越小,所以稀释氢氧化钠溶液,水的电离程度变大,故C错误;
D.水的电离是吸热反应,升高温度促进水电离,KW变大,H+浓度增大,故D正确;
故选D.
点评 本题以水电离为载体考查弱电解质的电离,为高频考点,明确水电离影响因素及溶液酸碱性判断方法是解本题关键,注意不能根据溶液中c(H+)大小判断溶液酸碱性,要根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,易错选项是A.


科目:高中化学 来源: 题型:解答题

 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
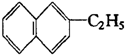 属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10).
属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10). ②丙的结构简式为
②丙的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体最外层电子数均为8个,很稳定 | |
| B. | 稀有气体的电子层数比较多,很稳定 | |
| C. | 稀有气体的最外层电子数均达到稳定结构 | |
| D. | 稀有气体的原子核所带电荷较多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol 0.50mol 0.12mol | B. | 0.66mol 0.50mol 0.24mol | ||
| C. | 0.64mol 0.50mol 0.24mol | D. | 0.64mol 0.02mol 0.24mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com