
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
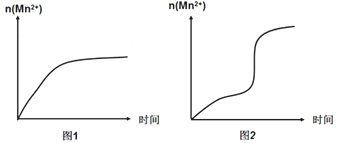
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。
【答案】 V1=2.0 V2=3.0 浓度 其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率 ②③ 1.0×10-2mol/(L·min) Mn2+对该反应有催化作用 加入MnSO4固体后,KMnO4溶液比实验②更快褪色
【解析】(1)利用实验②、③中的数据,可知溶液的总体积为10.0mL,所以实验①中V1=2.0mL,V2=3.0mL;(2)实验①、②其他条件相同,只有H2C2O4浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时间更短,则浓度大,反应速率大;(3)实验②和③的温度不同,其他条件相同;(4)溶液褪至无色即KMnO4反应完所需时间为1.5min,计算出用KMnO4表示的化学反应速率;(5)①由图2可知,反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是锰离子在反应中的作用;②若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少。
(1)实验①、②探究浓度对反应速率的影响,则其他条件应该是相同的,则溶液总体积应相同,故V1= 2.0mL;实验②、③是探究温度对反应速率的影响,则其他条件应该是相同的,则V2=3.0mL;(2)根据表中数据可知实验①、②探究的是浓度对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率;(3)根据表中数据可知探究温度对化学反应速率的影响,应选择②③;(4)草酸的物质的量为:0.6mol/L×0.003L=0.0018mol,高锰酸钾的物质的量为:0.05mol/L×0.003L=0.00015mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.00015mol=12:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() =0.015mol/L,这段时间内平均反应速率v(KMnO4)=
=0.015mol/L,这段时间内平均反应速率v(KMnO4)=![]() =0.01 mol/(Lmin);(5)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;②若该小组同学提出的假设成立,则反应速率加快,即加入MnSO4固体后,KMnO4溶液比实验②更快褪色。
=0.01 mol/(Lmin);(5)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;②若该小组同学提出的假设成立,则反应速率加快,即加入MnSO4固体后,KMnO4溶液比实验②更快褪色。


科目:高中化学 来源: 题型:
【题目】【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
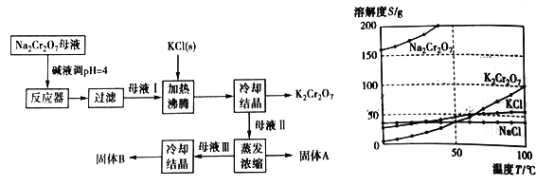
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。固体B的主要成分为___________________(填化学式)。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。进一步提纯产品的方法是___________________。
(5)+6价Cr的毒性很高,工业上用电解法来处理含Cr2O72-的废水。下图为电解装置示意图,电极材料分别为铁和石墨。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a 极附近变成Cr(OH)3沉淀而被除去。
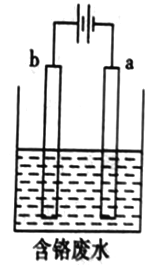
①在以上处理过程中,Cr2O72-转化为毒性较低的Cr3+的离子方程式为________________________。
②a电极的电极反应式是是____________________;电解一段时间后在阴极区有Fe(OH)3和Gr(OH)3沉淀生成,若电解后的溶液中c(Cr3+)为3×10-5mol·L-1,则溶液中c(Fe3+)为____________ mol·L-1。已知:Ksp=[Fe(OH)3]=4.0×10-38,K[Cr(OH)3]=6.0×10-31。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的O2在密闭容器中点燃,充分反应后,CH4和O2均无剩余,且产物均为气体(101kPa,120℃ ),总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则不能被完全吸收
B. 若将产物通过浓硫酸,充分吸收后,浓硫酸增重18g
C. 产物的平均摩尔质量为24g.mol-1
D. 反应中消耗O256g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题. 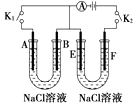
(1)打开K2 , 合并K1 . B为极,A的电极反应为 .
(2)打开K1 , 合并K2 . E为极,F极的电极反应为 , 检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C2H6O的化合物A具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH![]() 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是 ______ .
A.一定含有-OH B.一定含有-COOH C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用作 ______ .
(3)A与钠反应的化学方程式: ________________________________________ .
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为:________________ .
(5)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:___________________.
(6)如图是B分子的球棍模型和A分子的比例模型,若A和B的关系是同系物,则B的结构简式 ______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
A. SO2、O2浓度分别为0.4 mol·L-1、0.2 mol·L-1
B. SO3浓度为0.25 mol·L-1
C. SO3浓度为0.4 mol·L-1
D. SO3、SO2浓度均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图. 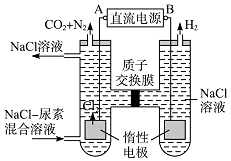
(1)电源的负极为(填“A”或“B”).
(2)阳极室中发生的反应依次为: , .
(3)电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素质量=g(忽略气体的溶解).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com