
【题目】2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
科目:高中化学 来源: 题型:
【题目】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程
如下:
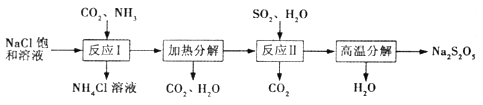
(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是______,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
a.稀硫酸 b.澄淸石灰水 c.品红溶液 d.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________价。![]() 是一种酸根离子,则Fe(CrO2)2属于__________(填“酸”、“碱”、“盐”或“氧化物”)。
是一种酸根离子,则Fe(CrO2)2属于__________(填“酸”、“碱”、“盐”或“氧化物”)。
(2)明胶的水溶液和K2SO4溶液共同具备的性质是_____________(填序号)。
a.都不稳定,密封放置沉淀
b.两者均有丁达尔效应
c.分散质粒子可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的____________(填序号)。
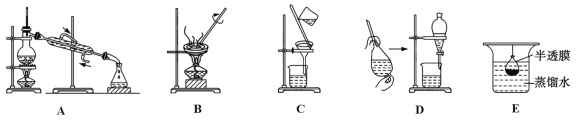
(4)现有10 mL明胶的水溶液与5 mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明![]() 能够透过半透膜:____________________________________。
能够透过半透膜:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是( )
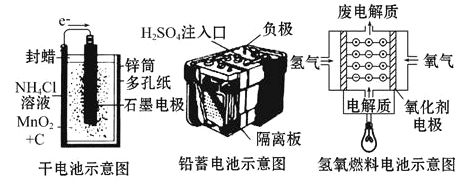
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助于图像这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是
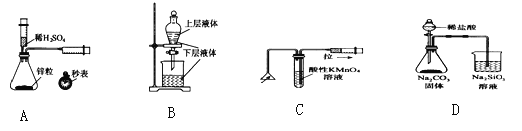
A. 测定一定时间内生成H2的反应速率 B. 提取海带中的碘
C. 检验火柴燃烧产生的SO2 D. 证明非金属性:Cl>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用四种基本反应类型的分类方法,分析下列反应各属于哪种类型的反应。
①2H2+O2![]() 2H2O ②CuO+H2
2H2O ②CuO+H2![]() Cu+H2O
Cu+H2O
③NH4HCO3![]() NH3↑+H2O↑+CO2↑ ④2CO+O2
NH3↑+H2O↑+CO2↑ ④2CO+O2![]() 2CO2
2CO2
⑤H2O(g)+C![]() H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
(1)化合反应:________。
(2)分解反应:________。
(3)置换反应:________。
(4)复分解反应:________。
(5)氧化还原反应:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的叙述不正确的是( )
A. 油脂属于酯类 B. 天然油脂没有固定的熔、沸点
C. 油脂是高级脂肪酸的甘油酯 D. 单甘油酯是纯净物,有固定的熔、沸点,混合甘油酯是混合物,没固定的熔、沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有弱碱性和强还原性.工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4H2O)、Na2CO3等产物.请回答:
(1)上述生成水合肼的反应中尿素是________( 填“氧化剂”或“还原剂”),反应的化学方程式为________.
(2)肼与盐酸反应可生成N2H6Cl2 , N2H6Cl2的水溶液显________性( 填“酸”或“碱”或“中”),用离子方程式表示其原因________.
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式________.
若要设计实验方案检验上述反应生成固体产物中的金属阳离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中; ②________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com