
【题目】向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,如图中的曲线可近似表示整个过程中混合溶液的导电能力变化的是(用电流强度I表示)

A. 曲线AB. 曲线BC. 曲线CD. 曲线D
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O.
(1)该反应中发生还原反应的物质是________。氧化产物是________。
(2)用双线桥标出方程式中的电子得失2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O________
(3)当有0.2 mol电子发生转移时,生成的氯气的体积为________L (标准状况)。被氧化的HCl的物质的量为________mol.
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+) ③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
Ⅱ.已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
(1)配平并用“双线桥法”表示上述反应中电子转移的方向和数目:___Cu+___HNO3(稀) = ___Cu(NO3)2+___NO↑+___H2O。___________
(2)该反应中氧化剂与还原剂的物质的量之比为_______;写出该反应的离子方程式______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[有机化学基础]
与有机物B相关的反应信息如下:
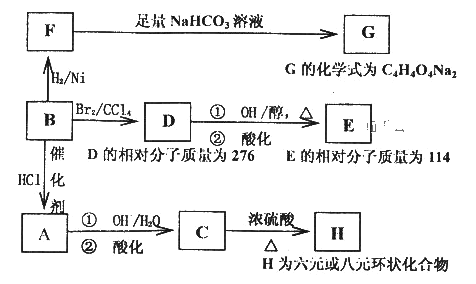
(1)写出下列反应的反应类型:
B→A______________,D→E第①步反应________________。
(2)写出E、C的结构简式:E_______________。C_______________。
(3)C的一种同分异构体K有如下特点:1molK可以和3mol金属钠发生反应放出33.6LH2(标准状况下),1molK可以和足量的NaHCO3溶液反应,生成1molCO2,1molK还可以发生银镜反应生成2molAg,试写出K的结构简式________________________。
(4)写出在浓硫酸存在并加热的条件下,F与足量乙醇反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
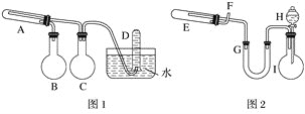
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是____________;烧瓶C的作用是__________;在试管D中收集得到的是__________。
(2)实验时,U形管G中应加入的试剂是____________;长颈漏斗H中应加入____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________________。
(4)试管E中发生反应的化学方程式是__________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须____________;E管中的反应开始后,在F出口处应________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
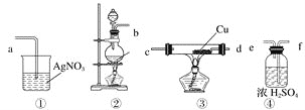
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为___________________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
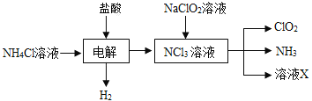
①电解时发生反应的化学方程式为_____________________________________。
②溶液X中大量存在的阴离子有_______________________________________。
③除去ClO2中的NH3可选用的试剂是______(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:

Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_________________________________。
②玻璃液封装置的作用是 ______________。
③V中加入的指示剂通常为__________,滴定至终点的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂,农业上常用作 复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3,还含有少量的Fe2O3、A12O3等杂质]为原料制备KH2PO4 晶体的一种流程如下:

回答下列问题:
(1)“酸浸”过程中生成磷酸的化学方程式为________,若用盐酸代替硫酸,磷酸的产率会明显提高,原因是___,该过程所用的仪器不能釆用二氧化硅陶瓷材料,其主要原因是_____________(用化学方程式表示)。
(2)己知物质A为CaCO3,其作用是调节溶液pH,则“废渣I”的主要成分为__________。
(3) “反应II ”的化学方程式为 _______。
(4)将获得的KH2PO4晶体进行进一步提纯的方法名称为____。
(5)若用1000kg质量分数为50.4%的氟磷灰石来制取磷酸二氢钾晶体,其产率为80%,则生产出的磷酸二氢钾晶体的质量为 _____kg. 已知摩尔质量 M(Ca5F(PO4)3)=504g/mol,M(KH2PO4)=136 g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol·L-1的CH3COOH溶液,pH变化曲线如图所示:

(1)该氢氧化钠溶液的物质的量浓度为__。
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:__。
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:______。
(4)B点所示溶液中,![]() =___。
=___。
(5)C点所示溶液为等浓度的CH3COONa和CH3COOH混合溶液,请判断该溶液中c(CH3COOH)__c(CH3COO-)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,A和B发生下列反应,A(s)+2B(g)![]() 2C(g)△H>0.在一定条件下达到平衡,若升高温度则达平衡后混合气体的
2C(g)△H>0.在一定条件下达到平衡,若升高温度则达平衡后混合气体的
A.平均相对分子质量增大 B.平均相对分子质量减小 C.密度减小 D. 气体压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com