
����Ŀ���̲IJ�ͼ���м������ں��ḻ���ص㡣��ش��������⣺
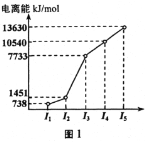
��1���������ڵ�ij����Ԫ�أ����һ�����������������ͼ1��ʾ�����Ԫ�ض�Ӧ��ԭ����___�ֲ�ͬ�˶�״̬�ĵ��ӡ�
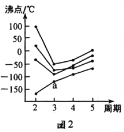
��2����ͼ2��ʾ��ÿ�����߱�ʾ���ڱ���A-��A�е�ijһ��Ԫ���⻯��ķе�仯��ÿ��С�ڵ����һ���⻯�����a���������___��
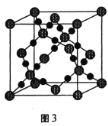
��3��CO2�ڸ��¸�ѹ�����γɵľ����侧����ͼ3��ʾ����þ������������___���塣
��4����һ�����ܽ���Al��P֮��ĵ�������Ԫ����___�֡�GaCl3ԭ�ӵ��ӻ���ʽΪ___��
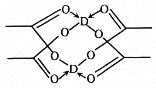
��5�������ɱ����ⶼ�Ƿ��Ӿ��壬���Ľṹ���������ԣ����ɱ�����ľ���������ƵĽṹ�������ɱ�������һ��������Χ��___�����ڷ��ӡ�D�Ĵ����ξ���ֲ��ṹ��ͼ���þ����к��еĻ�ѧ����___������ĸ��ţ���
a�����Լ� b���Ǽ��Լ� c����λ�� d��������
���𰸡�12 SiH4 ԭ�� 3 sp2�ӻ� 12 abc
��������
��1���������ͼ���������Ԫ�ص���������ԶԶ���ڵڶ������ܣ�˵����Ԫ�ص�ԭ�Ӽ۵�����Ϊ2��ΪþԪ�أ�������12�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2���ڢ�A����A�е��⻯���NH3��H2O��HF����Ӽ����������ʷе����ͬ��������Ԫ���⻯��ķе㣬ֻ�Т�A��Ԫ���⻯�ﲻ���ڷ������������ṹ���ƣ���Է�����Խ���Ӽ�������Խ�е�Խ�ߣ�a���������߶�Ӧ������̬�⻯��SiH4��
��3����CO2�ڸ��¸�ѹ�����γɵľ���ͼ���Կ������侧��ṹΪ�ռ�����ṹ��ÿ��Cԭ����Χͨ�����ۼ�����4��Oԭ�ӣ����Ըþ���Ϊԭ�Ӿ��塣
��4����һ�����ܽ���Al��P֮��ĵ�������Ԫ����þ���衢��3�֣�GaCl3������ԭ�ӵļ۲���Ӷ�����3���Ҳ����ڹ¶Ե��ӣ�ԭ�ӵ��ӻ���ʽΪsp2�ӻ���
��5�����ݸɱ��ľ����ṹ��֪���ڸɱ�������ÿ��CO2������Χ���ڵ� CO2������12������D�Ĵ����ξ���ֲ��ṹ֪���þ����к��еĻ�ѧ���м��Լ����Ǽ��Լ�����λ����ѡabc��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A.��ͭƬ����ϡ�����У�![]()
B.ϡ������Ba(OH)2��Һ��Ӧ��![]()
C.��A12(SO4)3��Һ�м��������ˮ��![]()
D.��Na2SiO3��Һ�еμӴ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��E��F�����ܱ������У���һ�������·�����Ӧ��E(s)+4F(g)![]() G(g)����֪�÷�Ӧ��ƽ�ⳣ��ֵ���±���ʾ������˵����ȷ����
G(g)����֪�÷�Ӧ��ƽ�ⳣ��ֵ���±���ʾ������˵����ȷ����
�¶ȡ� | 25 | 80 | 230 |
ƽ�ⳣ��ֵ | 5��104 | 2 | 1.9�� 10��5 |
A.������Ӧ��������Ӧ
B.25��ʱ����ӦG(g)![]() E(s)+4F(g)��ƽ�ⳣ��ֵ��0.5
E(s)+4F(g)��ƽ�ⳣ��ֵ��0.5
C.��80��ʱ�����ijʱ�̣�F��GŨ�Ⱦ�Ϊ0.5 mol��L��1�����ʱv(��)��v(��)
D.���º����£����������ٳ�������G(g)������ƽ��ʱ��G������ٷֺ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ������Һ��KIO3��KI��Ӧ����I2��IO![]() ��I����6H��===I2��3H2O
��I����6H��===I2��3H2O
B. ������Һ�е���Ba(OH)2��ҺʹSO42-ǡ����ȫ������2Ba2����3OH����Al3����2SO42-===2BaSO4����Al(OH)3��
C. �ù�����ˮ���չ�ҵβ���е�SO2��2NH3��H2O��SO2===2NH4+��SO32-��H2O
D. ��ͭ���缫���CuSO4��Һ��2Cu2����2H2O![]() 2Cu��O2����4H��
2Cu��O2����4H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯�����ת����ϵ��C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3![]() CO2�������漰�Ļ�����Ӧ����������( )��
CO2�������漰�Ļ�����Ӧ����������( )��
A.���ϡ��û����ֽ⡢���ֽ�
B.�û������ֽ⡢���ϡ��ֽ�
C.�û������ϡ����ֽ⡢�ֽ�
D.�û������ϡ��ֽ⡢���ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ�ǣ������������ʵ�������ȷ����( )
���ܷ����ӳɷ�Ӧ�� �����ܽ���NaOH��Һ�У� ����ˮ�����������л��
�ܲ���ʹ��ˮ��ɫ�� ���ܷ���������Ӧ�� ��������
A. �٢ڢ�B. �ڢۢ�C. ����D. ȫ����ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
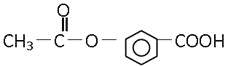
����Ŀ������Ϊ�ס��ҡ�����λͬѧ��ȡ����������ʵ����̡�
��ʵ��Ŀ�ģ���ȡ����������
��ʵ��ԭ�����ס��ҡ�����λͬѧ����ȡ�Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ����������
1.��װ����ƣ��ס��ҡ�����λͬѧ�ֱ��������������ʵ��װ��:
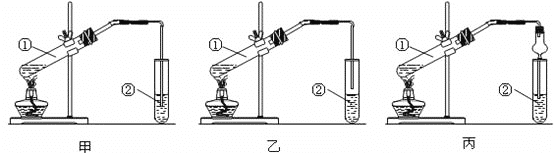
��Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã���Ӧѡ���װ����____(����������������)����ͬѧװ���е����θ���ܣ��������������⣬��һ��Ҫ������______��
2.��ʵ�鲽�裩
(1)��ѡ���װ����װ���������Թ����ȼ���amLCH3CH218OH���ܶ�Ϊ��g/cm-3�������ı�����(CH3COOH)��������������2mLŨH2SO4;
(2)���Թ̶ܹ�������̨��;
(3)���Թܢ��м��������ı���Na2CO3��Һ;
(4)�þƾ��ƶ��Թܢټ���;
(5)���۲쵽�Թܢ�������������ʱ��Ϊ��Ӧ������ɡ�
���������ۣ�
a.������(1)װ��ʵ��װ�ã�����ҩƷǰ��Ӧ______��
b.��(5)�У����۲쵽�Թܢ�����______����ʱ��Ϊ��Ӧ������ɡ�
c.�����Թܢ��еĻ������Եõ���Ʒ������δ��Ӧ��������Ҵ���ʵ�������������:
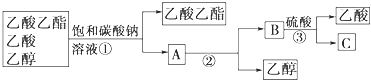
������ʵ����������У����漰�Ģ٢ڢ����η�������ֱ��ǣ�______��
d.��֪�����봼��������Ӧ�У���Ӧ��ԭ������ʧȥ�ǻ�����ʧȥ��ԭ�ӽ�ϳ�ˮ����д���Թܢ�����������������Ӧ�Ļ�ѧ����ʽ(ע����Ӧ����)_____________��
���õ���������������bg����ʵ�������������IJ��ʣ�______����a��b������ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ʵ����̽�����������(NH2COONH4)�ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
(1)��һ���������İ�������粒����������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)��ʵ���õIJ�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���õIJ�ͬ�¶��µ�ƽ�����������±���
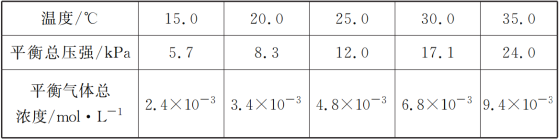
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽƽ�����___________
A. 2v(NH3)��v(CO2)
B. �ܱ���������ѹǿ����
C. �ܱ������л��������ܶȲ���
D. �ܱ������а����������������
�ڸ��ݱ������ݣ���ʽ����25.0 ��ʱ��������淋ķֽ�ƽ�ⳣ������ʽΪ________��ƽ�ⳣ��Ϊ________��
��ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0 ���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒��������_______ (����������������������������)��
�ܰ�������立ֽⷴӦ���ʱ���H________0(����������������������)���ر���S______0(����������������������)��
(2)��֪��NH2COONH4��2H2O![]() NH4HCO3��NH3��H2O��
NH4HCO3��NH3��H2O��
���о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨ��ˮ�ⷴӦ���ʣ��õ�c(NH2COO-)��ʱ��ı仯������ͼ��ʾ��
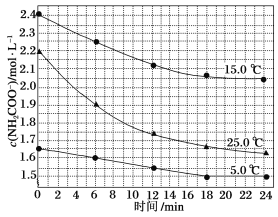
�ݼ���25.0 ��ʱ��0��6 min���������ˮ�ⷴӦ��ƽ�����ʣ�_______
����ͼ����Ϣ�����˵����ˮ�ⷴӦ�������¶����߶�����25.0 ��ʱ��Ӧ�����ʼŨ�Ƚ�С����0��6 min��ƽ����Ӧ����(���ߵ�б��)�Ա�15.0 ��ʱ��________(������������С��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п����صĸ���Ϊп������Ϊ���������������KOH����ط�ӦΪZn��Ag2O��H2O=Zn(OH)2��2Ag����п�����Ϊ��Դ�������������Һұ��������װ����ͼ��ʾ��
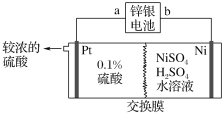
����˵����ȷ���ǣ� ��
A.װ����ʹ�������ӽ���Ĥ
B.п�����a����ӦʽΪAg2O��H2O��2e��=2Ag��2OH��
C.���������ϡ���ᣬ����õ��Ƚ�Ũ������
D.��п������ܽ�13gп�������������������Ϊ5.9g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com