
【题目】已知25℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)=1.3×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液。下列叙述中不正确的是
A.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
【答案】D
【解析】
依据氯化银和碘化银的溶度积比较溶解度,反应向更难溶的方向进行;依据碘化银和氯化银溶度积比较溶解度可知,碘化银溶解度小,反应中先析出碘化银; AgCl饱和溶液中c(Ag+)为1.30×10-5molL-1,溶液中存在沉淀溶解平衡AgCl(s)Ag++Cl-,氯离子浓度为1.30×10-5molL-1;依据Ksp=c(Ag+)c(Cl-)计算得到;根据溶解度判断沉淀的先后顺序,利用溶度积常数计算出各离子浓度,结合反应的程度比较溶液离子浓度的大小。
A.碘化银和氯化银溶度积比较溶解度可知,碘化银溶解度小,若在AgCl悬浊液中滴加KI溶液,如满足c(Ag+)c(I)>Ksp(AgI),则可生成黄色沉淀;
B.由已知条件知, AgI的Ksp较小,则先产生的是AgI沉淀,故B正确;
C.在AgCl饱和溶液中c(Ag+)=1.30×105molL1,溶液中存在沉淀溶解平衡AgCl(s)Ag++Cl,c(Cl-)=1.30×105molL1,由Ksp=c(Ag+)c(Cl-)=1.30×105molL1×1.30×105molL1=1.69×1010 mol2L2,故C正确;
D.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,首先生成AgI沉淀,反应后剩余n(Ag+)=0.003L×0.01mol/L=3×105mol,继续生成AgCl沉淀,反应后剩余n(Cl)=0.005×0.01mol/L3×105mol=2×105mol,c(Cl)=![]() =1.53×103mol/L,浊液中c(Ag+)═
=1.53×103mol/L,浊液中c(Ag+)═ =
= =1.1×107(mol/L),c(I)═
=1.1×107(mol/L),c(I)═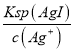 =
= =1.35×109(mol/L),混合溶液中n(K+)=1×104mol,n(NO3)=0.008L×0.01mol/L=8×105mol,则c(K+)>c(NO3),故c(K+)>c(NO3)>c(Cl)>c(Ag+)>c(I),故D错误;
=1.35×109(mol/L),混合溶液中n(K+)=1×104mol,n(NO3)=0.008L×0.01mol/L=8×105mol,则c(K+)>c(NO3),故c(K+)>c(NO3)>c(Cl)>c(Ag+)>c(I),故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如左下图所示,用Cu—Si合金作硅源,在950℃下利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(如下图所示)作为电源。下列有关说法不正确的是

A. 电极c与b相连,d与a相连
B. 左侧电解槽中;Si优先于Cu被氧化
C. a极的电极反应为CH4-8e—+4O2— ===CO2+2H2O
D. 相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.己知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.单质中不可能含有离子键
D.第ⅥA族元素的氢化物中,稳定性最强的其沸点最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列叙述中正确的是
A.溶液中:c(H+)=c(OH-)+c(SO42-)
B.NaHSO4属于酸式盐,加入水中促进水的电离
C.1 mol NaHSO4晶体中含有的离子总数为3NA
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,A是氯气发生器,C.D为气体净化装置,其中C中装有饱和食盐水,D中装有浓硫酸,E为装有细铜丝网的硬质玻璃管,F为干燥的广口瓶,烧杯G中装有氢氧化钠溶液。
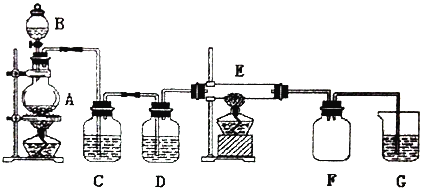
(1)C装置的作用是___,D装置的作用是___。
(2)E装置中发生的化学反应方程式是___。
(3)F装置的作用是___。
(4)G装置中所发生反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。

(1)若A为短周期元素的金属单质,D为短周期元素的非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是________________。已知1g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:_______________________。
(3)若A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________,B固体属于____________晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认反应混合气体中含有乙烯和二氧化硫,装置如图所示,试回答下列问题。
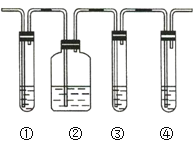
(1)图中①②③④装置可盛放的试剂分别是___________________(填序号,下同)、___________________、___________________、___________________。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性
溶液 C.浓硫酸 D.酸性![]() 溶液
溶液
(2)能说明二氧化硫气体存在的现象是______________________________________。
(3)使用装置②的目的是________________________,使用装置③的目的是________________________。
(4)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com