
已知HCN、CN‑在溶液中存在下列平衡及其对应的平衡常数:
①HCN H++CN- △H1>0 K1
H++CN- △H1>0 K1
②CN‑+H2O HCN+OH- △H 2>0 K2
HCN+OH- △H 2>0 K2
常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
A.混合溶液的pH<7
B.对混合溶液进行微热,K1 增大、K2 减小
C.K2≈1.6×10-5
D.c(Na+) = c(HCN) + c(CN‑)
科目:高中化学 来源:2015-2016学年广东广州执信中学高一上期中考试化学试卷(解析版) 题型:选择题
下列物质都能导电,其中属于电解质的是
A.NaCl溶液 B.铁丝 C.稀硫酸 D.熔融的NaOH
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如图,其中只有M元素最外层电子数与电子层数相等,下列说法不正确的是
Y | Z | ||
M | X |
A.原子半径Z<M
B.非金属性:X<Z
C.M元素最高价氧化物对应水化物具有两性
D.Y的最高价氧化物对应的水化物的酸性比X的弱
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:填空题
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾,溴,镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:填空题
铝是人类生活中继铜、铁之后又一个重要的金属。工业上冶炼金属铝的原料来源于自然界中重要的矿物质钒土(主要成分:Al2O3;还有SiO2、Fe2O3、FeCO3、MgCO3等杂质)。从钒土中提取得到Al2O3的工艺流程如下图所示:
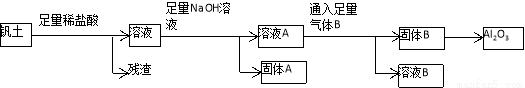
请回答下列问题:
(1)固体A所含物质的化学式(或分子式)是_____________________________。
(2)写出溶液A与气体B反应的离子方程式________________________________。
(3)工业冶炼金属铝通常用石墨碳块作电解槽的阳极,请你根据电解原理解释电解冶炼铝过程中,需要定期补充阳极碳块的原因____________________________。
(4)Al2O3的熔点很高,因而在工业冶炼时,需将Al2O3的熔于熔化的冰晶石(Na3AlF6)中进行电解。有一位同学查阅资料发现,AlCl3的熔点很低。他提出:可通过电解熔融状态的AlCl3制取金属铝。你认为他提出的方案是否可行?为什么?______________________________________________。
(5)另一位同学分析了“从钒土中提取Al2O3的工艺流程”后指出:可以从“溶液B”中分离得到另一个重要的化工产品——小苏打。根据这位同学的想法,如果不考虑生产过程的损耗,请你计算每生产10.0t金属铝,理论上可得到小苏打产品___________t。
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质在生活中应用时,起氧化作用的是
A.明矾作净水剂
B.漂粉精作消毒剂
C.甘油作护肤保湿剂
D.铁粉作食品袋内的 脱氧剂
脱氧剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南二校高一理科实验班上联考2化学卷(解析版) 题型:实验题
在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
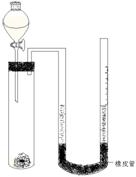
①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2 mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后, ,(2分)读出右边玻璃管的液面刻度为V2 mL。
请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作 。(2分)
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)= ,你认为此表达式求出的值是否准确? (填‘是’或‘不’),主要问题为 (若回答‘是’则此空不填)。(2+1+1=4分)
(3)步骤①中,为什么要用铜网包住镁条? 。(2分)
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高一12月化学卷(解析版) 题型:填空题
(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________________。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________________。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为________mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________同学的说法正确,理由是____________________________。
(4)明矾[KAl(SO4)2·12H2O]常用作净 水剂,其原理是_______________(用离子方程式表示)。
水剂,其原理是_______________(用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________(填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)在稀硫酸与锌反应制取氢气的实验中,探究加入硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0~4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336mL)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
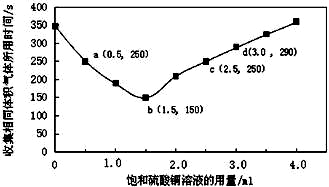
A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a、c两点对应的氢气生成速率相等
C.b点对应的反应速率为v(H2SO4) = 1.0×10-3 mol·L-1·s-1
D.d点没有构成原电池,反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com