


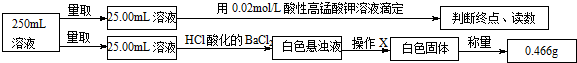
分析 (1)根据称量黄铜矿样品1.150g,选择精确度较高的仪器;将样品研细,增大了接触面积;
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;
(3)反应产生的二氧化硫应该尽可能的被d装置吸收;
(4)根据滴定管的读数方法读出消耗碘溶液的体积,根据反应结束时的颜色变化判断滴定终点;
(5)先找出黄铜矿和二氧化硫及碘单质的关系式CuFeS2~2SO2~2I2,再根据题中数据进行计算;
(6)图2中的f中通入二氧化硫,反应生成了硫酸钡沉淀,可以根据硫酸钡的质量计算二氧化硫的量.
解答 解:(1)由于称量黄铜矿样品1.150g,精确度达到了千分之一,应该选用电子天平进行称量,把黄铜矿样品研细,可以增大接触面积,从而提高反应速率,并且使黄铜矿充分反应,
故答案是:电子天平;提高反应速率,并使黄铜矿充分反应;
(2)装置a中的浓硫酸可以吸收空气中的水蒸气,防止水蒸气进入反应装置b中发生危险,同时根据冒出的气泡的快慢来控制气体的通入量,黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然需要通入一段时间的空气,可以将b、d装置中的二氧化硫全部排出去,使结果更加精确,
故答案为:除去空气中的水蒸气,便于观察空气流速;把装置中的二氧化硫气体全部吸收;
(3)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,
故答案为:20.00;溶液由无色变成蓝色,并半分钟内不褪色;
(5)根据硫原子守恒和电子守恒找出关系式:CuFeS2~2SO2~2I2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.15g}$×100%=80%,
故答案为:80%;
(6)由于图2中,f中硝酸钡溶液中通入二氧化硫能够生成硫酸钡沉淀,过滤干燥后,根据硫酸钡的质量计算出二氧化硫的质量,
故答案为:f.
点评 本题考查了探究黄铜矿的纯度,涉及了仪器选择、纯度计算等知识,题量较大,充分考查了学生分析和解决问题的能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该有机物不能发生加成反应,但能发生取代反应 | |
| B. | 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 | |
| C. | 该有机物分子中的所有原子可能在同一平面上 | |
| D. | 该有机物的一溴代物最多有11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 常见气态氢化物的稳定性:X<Y<Z | |
| C. | 1molWM溶于足量水中完全反应,共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
| 丙烯酸 | 142℃ | 与水互溶,易溶于有机溶剂 | 54℃ | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 11℃ | 有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
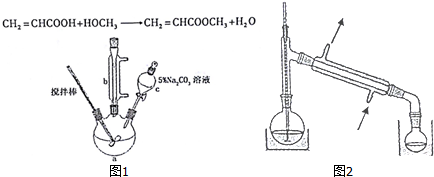
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数大小顺序为Z>Y>X | B. | W、X的简单离子能抑制水的电离 | ||
| C. | 单质的熔点大小顺序为X>W>Y | D. | 原子半径大小顺序为X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀硫酸改成浓硫酸 | B. | 将纯锌换成含铜、铅等杂质的粗锌 | ||
| C. | 往稀硫酸中滴加浓度更大的硝酸 | D. | 往稀硫酸中加入K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com