
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)①将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
②将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(2)利用如图装置可以验证非金属性的变化规律. 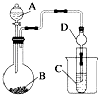
③实验室中提供药品Na2S,MnO2、浓盐酸、KMnO4 , 若要证明非金属性Cl>S;装置A,B,C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
④若要证明非金属性:C>Si,则A中加、B中加Na2CO3、C中加Na2SiO3 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 . (假设所通气体是过量的).
【答案】
(1)2Al+6H+=2Al3++3H2↑;不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3H2O不是N元素最高价氧化物对应的水化物
(2)浓盐酸、KMnO4、Na2S;S2﹣+Cl2=S↓+2Cl﹣;硫酸或H2SO4;SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣
【解析】解:(1)①同一周期元素,金属性随着原子序数增大而减弱,元素的金属性越强,同一主族,原子序数越大,金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则K与盐酸反应最剧烈、Al与盐酸反应速率最慢,离子反应为:2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;②将NaOH溶液与NH4Cl溶液混合生成NH3H2O,可以说明NaOH的碱性大于NH3H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而NH3H2O不是氮元素的最高价氧化物的水化物,故答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3H2O不是N元素最高价氧化物对应的水化物;(2)③设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2﹣+Cl2═S↓+2Cl﹣ , 故答案为:浓盐酸、KMnO4、Na2S;S2﹣+Cl2═S↓+2Cl﹣;④若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中加Na2CO3 , 故A中可以加硫酸,通过硫酸和碳酸钠的反应来制取CO2 , 然后的CO2通入C中的Na2SiO3中,可以发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3 , 离子反应为:SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ , 产生白色胶状沉淀,从而可以证明酸性:H2CO3>H2SiO3 , 故非金属性:C>Si.故答案为:硫酸或H2SO4;SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ .
(1)①元素的金属性越强,其单质与酸或水反应越剧烈;②元素的最高价氧化物的水化物的碱性越强,元素的金属性越强;(2)③设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;④要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明.


科目:高中化学 来源: 题型:
【题目】今有120mL0.20mol/L Na2CO3的溶液和某浓度的200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.1.5 mol/L
B.2.0mol/L
C.0.18 mol/L
D.0.24mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.NaHCO3受热易分解,可用于制胃酸中和剂
B.铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板
C.SiO2熔点高硬度大,可用于制光导纤维
D.铝热反应能放出大量的热,常用作焊接钢轨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是
A.乙烯使酸性高锰酸钾溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色
D.甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种不溶于水、酸和乙醇的固体,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装罝如下图所示:
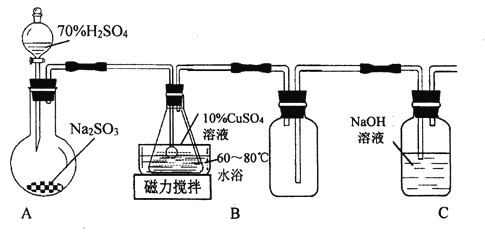
(1)装置A在常温下制取SO2时,用70%硫酸而不用稀硫酸和98%浓硫酸,其原因是________。
(2)装置B中发生反应的离子方程式为_________。
(3)装置C的作用是__________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。检验己洗涤完全的方法是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O) 的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,边搅拌边向其中滴入______溶液,加入适最纯净的________调节3.2<pH<4.2,静置,过滤,将滤液水浴加热蒸发浓缩至表面出现晶膜,冷却结晶,过滤,用95% 酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2 (5.8, 8.8); Cu(OH)2 (4.2, 6.7); Fe(OH)3 (1.1,3.2)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓“地沟油”是从一些饭店、酒店的下水道里捞出来的残油剩渣、饭店的“泔水油”以及垃圾猪肉加工成“食用油”。制作过程:①捞去废油中的悬浮杂质;②加入双氧水进行漂白;③加入工业消泡剂(内含铅、砷等元素及苯环、杂环等化合物);④高温炼制;⑤包装成成品油出售到不法的火锅店、饭店、工厂和学校餐厅。以下判断正确的是( )
A.“地沟油”外观与普通食用油一样,经过以上处理的“地沟油”具有固定的熔沸点
B.“地沟油”可用来作化工原料,如制作肥皂等产品
C.“地沟油”在加入消泡剂后,消除对人体健康的影响
D.“地沟油”中主要成分是蛋白质,还含有较多微量元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com