
将适量铜粉放入硫酸铁溶液中,完全反应后,溶液中的Cu2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和原溶液中Fe3+总物质的量之比是
A.2 :3 B.3 :2 C.2 :5 D.1 :2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
小明等同学为了探究酸、碱、盐溶液的导电性,设计了如下实验:
①在5只250 mL烧杯中分别加入浓度为0.1 mol·L-1的盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液、氨水各150 mL。
②在5种溶液中分别放入相同规格的石墨电极,按下图连接好。
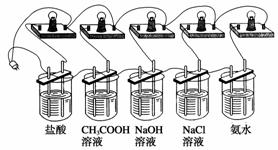
③接通电源,仔细观察现象。
现象1:五个灯泡都亮起来。
结论:_________________________________________________________________。
现象2:盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,醋酸、氨水对应的灯泡较暗。
结论:__________________________________________________________________
________________________________________________________________________。
思考:
(1)酸、碱、盐溶液导电与金属导电的原理是否相同,为什么?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
(2)同学们为了探究不同电解质之间电离能力的差异,设计了上述实验,通过观察灯泡的明亮程度,判断电解质的电离能力大小,为此必须控制其他能影响灯泡亮度的一些因素,使之保持一致,从而不影响灯泡的明亮程度。在本实验中,采取了哪些主要措施来控制其他因素对灯泡亮度的影响?(写出三条即可)_______________________________________
______________。
(3)小明同学根据现象2得出一个结论:氯化氢、氯化钠、氢氧化钠是强电解质,醋酸、一水合氨是弱电解质。你同意他这个观点吗?为什么?___________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)为了进一步探究氯化氢等化合物是强电解质,小红同学在老师的帮助下测定了0.1 mol·L-1的盐酸中的氢离子浓度,通过对结果的分析,即可得出结论。说明氯化氢是强电解质的理由是:测得溶液中的氢离子浓度________ 0.1 mol·L-1(选填“>”、“<”或“=”)。
(5)同学们在实验的基础上,进一步查阅资料得知:一般来说,________________
是强电解质,________________________________________是弱电解质。根据以上结论推测:如果将上述实验中的醋酸和氨水混匀,然后分别盛放在原来的烧杯中。接通电源,可以观察到的现象是________(填字母代号)。
A.与混合前无任何区别
B.5只灯泡都亮起来,亮度完全相同
C.只有盐酸、氯化钠、氢氧化钠溶液对应的灯泡亮起来,另外两只不亮
D.5只灯泡都亮起来,盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,另外两只略暗,但明显比混合前明亮
查看答案和解析>>
科目:高中化学 来源: 题型:
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:
①加入稍过量的BaCl2溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的Na2CO3溶液;
④过滤;
⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,包含以下操作步骤:①固定铁圈位置;②放上蒸发皿(蒸发皿中盛有NaCl溶液);③放置酒精灯;④加热搅拌;⑤停止加热。其正确的操作顺序为________________________。
(2)如何运用最简单方法检验粗盐的提纯步骤①后溶液中有无S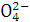 ?
?
_________________________________________________________________。
(3)步骤③加入稍过量的Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是 ______________________________________________________________。
(4)步骤④为过滤操作。请问这一操作能除掉哪些杂质? __________________
_________________________________________________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的作用分别是: ____________________________
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液能与铝作用生成H2,则溶液中一定可以大量共存的离子组是
A.Cl—、Ba2+、Mg2+、ClO— B.Cl—、SO42-、Cu2+、Mg2+
C.Cl —、SO42-、K+、Na+ D.HCO3—、NO3—、Na+、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.偏铝酸钠中通足量的CO2:2AlO2— + CO2 + 3H2O = 2Al(OH)3↓ + CO32—
B.铜制印刷电路板:3Cu + 2Fe3+ == 3Cu2+ + 2Fe
C.SO2气体通入氯水中:SO2 + Cl2 + 2H2O == 4H+ + Cl—+ SO42—
D.向水玻璃中滴加盐酸:Na2SiO3 + 2 H+ == H2SiO3 ↓+ 2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
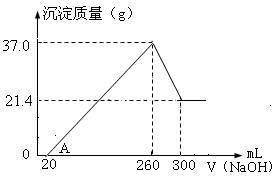
将Fe2O3 、Al2O3 两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
⑴A点坐标(20,0),0到A点的离子反应方程式为
⑵原混合物中Fe2O3的质量是 g
⑶所用NaOH溶液物质的量浓度为多少?
解题过程:
⑷稀硫酸物质的量浓度为多少?
解题过程:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.可利用在空气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞试液中,最终溶液均为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
①电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深。②将一束光通过乙液体,无丁达尔现象。③将乙慢慢地加入到丙溶液中,先出现凝聚,后液体变清。试推断甲为________,乙为______________,丙为____________,丁为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com