
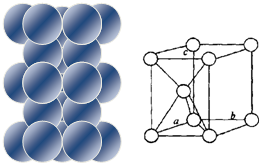
 | (1)镁原子在二维空间的配位数为6 (2)位于晶胞中部的镁原子与离它最近两平面相切(填“相离”或“相切”或”相交”) |
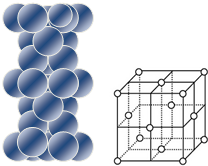 | (3)铜原子在三维空间的配位数为12 (4)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$g/cm3(根号带在分子上) |
分析 (1)金属镁是六方最密堆积,镁原子在二维空间为密置层排列方式;
(2)位于晶胞中部的镁原子与图中连接的六个原子相邻,且与上下3个原子分别形成正四面体结构,如图 ,即晶胞中部Mg原子与晶胞上下面相切;
,即晶胞中部Mg原子与晶胞上下面相切;
(3)以顶点Cu原子为研究对象,与之相邻的Cu原子处于面心,补全晶胞可知,每个顶点为12个面共用;
(4)晶胞为面心立方结构,面上处于对角线的3个Cu相邻,则晶胞棱长为4R2cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$R2cm,进而计算晶胞体积,利用均摊法计算晶胞中Cu原子数目,进而计算晶胞质量,根据V=$\frac{m}{ρ}$计算Cu的密度.
解答 解:(1)金属镁是六方最密堆积,镁原子在二维空间为密置层排列方式,Mg原子配位数为6,故答案为:6;
(2)位于晶胞中部的镁原子与图中连接的六个原子相邻,且与上下3个原子分别形成正四面体结构,如图 ,即晶胞中部Mg原子与晶胞上下面相切,
,即晶胞中部Mg原子与晶胞上下面相切,
故答案为:相切;
(3)以顶点Cu原子为研究对象,与之相邻的Cu原子处于面心,补全晶胞可知,每个顶点为12个面共用,即铜原子在三维空间的配位数为12,
故答案为:12;
(4)晶胞为面心立方结构,面上处于对角线的3个Cu相邻,则晶胞棱长为4R2cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$R2cm,晶胞体积为(2$\sqrt{2}$R2cm)3,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{4×64}{{N}_{A}}$g,Cu的密度为:$\frac{4×64}{{N}_{A}}$g÷(2$\sqrt{2}$R2cm)3=$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$g/cm3,
故答案为:$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$.
点评 本题考查晶胞计算,理解晶胞结构是关键,需要学生具备一定空间想象与数学计算能力,为易错题目,难度较大,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
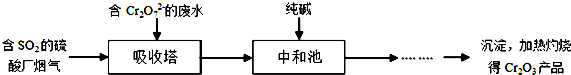
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
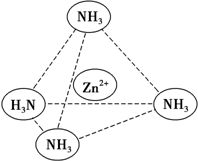 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
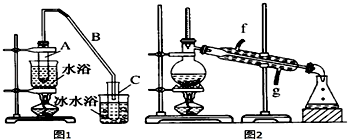

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 储氢、释氢过程均无能量变化 | |
| B. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 | |
| C. | 上述储氢原理和钢瓶储氢原理相同 | |
| D. | NaHCO3含有离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com