
| A. | v(O2)=0.225 mol•L-1min-1 | B. | v(H2O)=0.375 mol•L-1min-1 | ||
| C. | v(N2)=0.125 mol•L-1min-1 | D. | v(NH3)=0.250 mol•L-1min-1 |
分析 设反应消耗的NH3为4xmol,4NH3(g)+3O2(g)?2N2(g)+6H2O(g),
起始(mol) 4 3 0 0
反应量(mol) 4x 3x 2x 6x
平衡量(mol) 4-4x 3-3x 2x 6x
4min后,测得生成的H2O占混合气体体积的40%,则$\frac{6x}{7+x}$×100%=40%,解得:x=0.5,则反应消耗氨气的物质的量为2mol,
然后根据v=$\frac{\frac{△n}{V}}{△t}$计算出用氨气表示的反应速率,然后利用化学计量数与反应速率的关系判断.
解答 解:设反应消耗的NH3为4xmol,4NH3(g)+3O2(g)?2N2(g)+6H2O(g),
起始(mol) 4 3 0 0
反应量(mol) 4x 3x 2x 6x
平衡量(mol) 4-4x 3-3x 2x 6x
4min后,测得生成的H2O占混合气体体积的40%,则$\frac{6x}{7+x}$×100%=40%,解得:x=0.5,则反应消耗氨气的物质的量为2mol,
用氨气表示的反应速率为:v(NH3)=$\frac{\frac{2mol}{2L}}{4min}$=0.250mol•L-1•min-1,
A.v(O2)=$\frac{3}{4}$v(NH3)=0.250mol•L-1•min-1×$\frac{3}{4}$=0.1875mol•L-1•min-1,故A错误;
B.v(H2O)=$\frac{6}{4}$v(NH3)=0.250mol•L-1•min-1×$\frac{6}{4}$=0.375mol•L-1•min-1,故B正确;
C.v(N2)=$\frac{2}{4}$v(NH3)=0.250mol•L-1•min-1×$\frac{2}{4}$=0.125mol•L-1•min-1,故C正确;
D.v(NH3)=0.250mol•L-1•min-1,故D正确;
故选A.
点评 本题考查了化学反应速率、化学平衡的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与氢氧化钠溶液反应生成67.2LH2时,转移的电子数为9NA | |
| B. | 2L0.5mol/L醋酸钠溶液中含CH3COO-个数小于NA | |
| C. | 28gCO和C2H4的混合气体中含有的碳原子总数为1.5NA | |
| D. | 2molSO2与2molO2在密闭容器中充分反应后,容器内的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS 2 仅作还原剂,硫元素被氧化 | |
| B. | 每生成1mol Cu2 S,有4 mol硫被氧化 | |
| C. | SO 2 只是氧化产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.2mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液中:K+、Ca2+、C1-、NO${\;}_{3}^{-}$ | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO${\;}_{4}^{2-}$、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
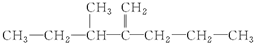 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯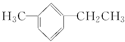 ,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.
,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.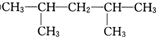
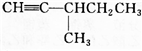 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比纯铁更易锈蚀 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 纯银器在空气中表面渐渐变暗是因为发生了原电池反应 | |
| D. | 充电电池的充放电次数有限是由它的工作原理所决定的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com