
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)
查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1) 。
(2)D装置的作用是 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是 。
A亚硝酸盐是还原剂
B维生素C是还原剂
C维生素C将Fe3+还原Fe2+
D亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是
A 测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
小刚同学利用下图所示装置进行实验(图中a、b、c表示止水夹)。请按要求填空: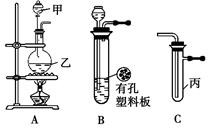
(1)若用二氧化锰和浓盐酸制取纯净干燥的氯气,则要用到上述仪器及顺序为:A→ 。
(2)利用B装置可制取的气体有 (填2种)。
(3)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。B中发生反应的化学方程式为 。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5为77.1℃;C2H5OH为78.3℃;C2H5OC2H5(乙醚)为34.5℃;CH3COOH为118℃。实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏。由上面的实验可得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)反应中加入的乙醇是过量的,其目的是 。
(2)边滴加醋酸,边加热蒸馏的目的是 。
将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向产品中加入 (填字母)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡,分离,其目的是 。
(5)然后再向其中加入无水硫酸铜,振荡,其目的是 。最后,将经过上述处理后的液体加入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集沸点在76℃~78℃之间的馏分即得纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是:
(2)在洗涤操作中,第一次水洗的主要目的是: ; 第二次水洗的主要目的是: 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是:
(6)在蒸馏操作中,仪器选择及安装都正确的是: (填标号)
(7)本实验的产率是:
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或者低)原因是
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3;CaC2+2H2O = C2H2↑+Ca(OH)2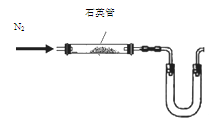
(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
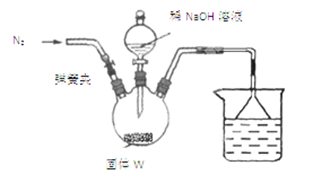
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(13分)醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)检查虚框内装置气密性的方法是 。
(2)醋酸钠溶液应放在装置 中(填写装置编号,下同);盐酸应放在装置 中;
装置4的作用是 。
(3)本实验中所有配制溶液的水需煮沸,其原因是 。
(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是 阀门A、 阀门B (填“打开”或“关闭”)。
(5)本实验中锌粒须过量,其原因是 。
(6)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)天然水是人类饮用水的主要来源。从天然水获得可以饮用的水一般须经过沉降悬浮物、杀菌消毒等步骤。
(1)沉降悬浮物要在水中加入絮凝剂,如将铝盐加入水中能达到净水目的,
原因是 (用离子方程式表示)。
(2)氯气可用于自来水杀菌消毒剂,结合离子方程式和文字理由 。
(3)新型水处理剂高铁酸钾 (K2FeO4)具有强的氧化作用和絮凝作用。工业上可通过以下流程制备高铁酸钾: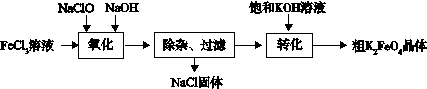
查阅资料:高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定。
完成“氧化”过程中的离子方程式
□Fe3+ + □ClO- +□ ="□" FeO42- + □Cl- + □
“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者 性的不同。
③结合资料完成粗K2FeO4晶体的提纯:将粗产品用 溶解,然后再加入饱和KOH溶液、冷却结晶、过滤。
④高铁酸钾的应用还在不断扩展中。如可制成高铁电池, 电池反应为:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
放电时,正极反应为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物(如FeS等)。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。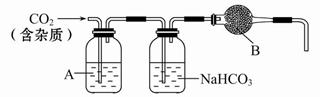
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是_____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是_____溶液,NaHCO3溶液可以吸收_____。
(3)上述装置中,B物质是_____。把这个实验得到的气体收集起来,用来测定CO2的分子量,如果B物质失效,测定结果_____(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重,为了将石蜡溶出,应选用的试剂是_____,碳酸钙溶出,应选用的试剂是_____。
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_____,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
选用适当装置、试剂和方法可制备中学化学中的几种常见气体。请填写表中的空格(从①~⑩中选择,填序号):
| 实验 | 气体 | 所用装置 | 气体性质 | 干燥该气体选用的试剂 |
| (1) | | ③ | 其水溶液显碱性 | |
| (2) | | | 1mol最多能与2molH2反应 | ⑩ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com