
【题目】下列说法正确的是
A. 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:
c(Na+)=c(SO4-)>c(NH4+)>c(H+)>c(OH-)
B. 25℃时,0.1mol L-1的HA溶液中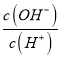 = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
【答案】A
【解析】A、等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合,反应生成Na2SO=、H2O、(NH4)2SO4;Na+、SO42-不水解,故c(Na+)=c(SO42-),NH4+水解显酸性,所以c(H+)>c(OH-),即离子浓度由大到小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),选项A正确;B、 25℃时,0.1mol L-1的HA溶液中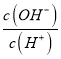 = 1×10-8,Kw=c(H+) c(OH-)=l×10-14,则该溶液中由水电离出的c(H+)=l×10-11mol·L-1,选项B错误;C、25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,碱越弱所加的水应该越多,则前者稀释的倍数更大,选项C错误;D、不能以溶度积的大小来说明电解质的强弱,BaSO4是在水溶液中全部电离成离子的化合物,属于强电解质,选项D错误。答案选A。
= 1×10-8,Kw=c(H+) c(OH-)=l×10-14,则该溶液中由水电离出的c(H+)=l×10-11mol·L-1,选项B错误;C、25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,碱越弱所加的水应该越多,则前者稀释的倍数更大,选项C错误;D、不能以溶度积的大小来说明电解质的强弱,BaSO4是在水溶液中全部电离成离子的化合物,属于强电解质,选项D错误。答案选A。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是( )
选项 | 实验现象 | 结论 |
A | 方形金属钠变成小球 | 钠与水的反应吸热 |
B | 钠浮于水面游动 | 水的密度大于钠的 |
C | 酚酞溶液变成红色 | 有碱性物质生成 |
D | 钠球游动有吱吱声 | 有气体生成 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了人类的可持续发展,我们应综合利用资源.保护环境,跟自然 和谐相处:
(1)科学家研制出有“自我修复能力”的塑料.塑料属于(选填“无机”、“合成”或“复合”)材料,为我们到来了方便,但废弃塑料处理不当会对环境造成不利的影响,人们把废弃塑料给环境带来的危害称为“”,发电厂是利用垃圾焚烧产生的转变为电能.
(2)发射“嫦娥三号”的长三甲火箭燃料是偏二甲肼(X),反应的化学方程式为:X+2N2O4=3N2+2CO2+4H2O,则X的化学式为
A.H2
B.CH4
C.C2H8N
D.C2H8N2
(3)2014年3月22日是第二十二个“世界水日”,它的主题是“水与能源”.关于水的知识有下列话题,请按要求填空: ①自来水生产过程中,可用方法除去水中不溶性杂质.
②在生产生活中水是最常用的溶剂,实验室用蔗糖配制一定溶质质量分数的溶液时,可能涉及以下操作: 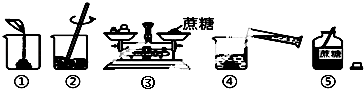
Ⅰ、如图操作中有错误的是(填序号).
Ⅱ、改正错误后,表示正确的操作顺序是(填序号).
A.⑤②①③④B.⑤①②③④C.⑤③②④①D.⑤③①④②
Ⅲ、保护水环境、珍爱水资源,是每个公民应尽的责任和义务.下列做法不利于保护水资源的是(填序号).
A.大量使用化肥农药 B.工业废水处理达标后再排放
C.使用含磷洗衣粉 D.生活污水直接排放.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O与D2O的pKw(p/Cw=-lgKw)与温度的关系如图所示,下列有关说法正确的是
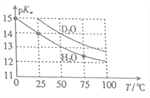
A. 常温下,向D2O中加入DCl,pKw变大
B. 25℃时,纯D2O的pH等于7
C. 25℃时,pH=7的液体一定是纯H2O
D. D2O的电离过程为吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,把装有NO和 NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的3/5,则原混合气体中NO和NO2的体积比为( )
A.2:3 B.3:2 C. 5:3 D.3:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室用如图所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH为4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸钠粉末至溶液PH为7~8;
Ⅲ.再通入SO2至溶液PH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体。
(1)制备焦亚硫酸钠总反应的化学方程式为___________________ 。
(2)Na2S2O5能与水发生化合反应,反应后所得的溶液显酸性。用电离方程式表示溶液显酸性的原因:____________________。
(3)利用碘量法可测定Na2S2O5产品中硫的含量。实验中必须使用的试剂有c1mol·L-1的标准碘溶液、c2 mol·L-1的标准Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。请补全实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,____________________________。重复上述步骤2次,记录数据。
(4)含铬酸性废水中常含有+ 6价铬。利用Na2S2O5和FeSO4·7H2O分两个阶段先后处理含Cr2O72-的废水, Cr2O72-被还原为Cr3+,实验结果如图。

①0~40 min内用Cr2O72-表示的平均反应速率为____________mol L-1 min-1。
②60~80 min内Cr2O72-与Fe2+发生反应的离子方程式为_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有多种污染物。一定条件下,通过下列反应可实现汽车尾气的合理排放:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
若反应在恒容的密闭容器中进行,下列说法正确的是( )
A. 随着反应的进行,容器内压强逐渐减小
B. 及时分离出N2或CO2,正反应速率加快
C. 其他条件不变时降低温度,可提髙反应物的转化率
D. 其他条件不变时使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
Ⅰ. 人体碘的重要来源之一是食用加碘食盐(含KIO3)。为检测食盐中的KIO3,并测定加碘食盐样品的碘含量,某实验小组设计了如下实验:
①用天平准确称取w g食盐样品,加适量蒸馏水使其完全溶解。
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全生成I2。
③以淀粉为指示剂,逐滴加入浓度为2.0×10-3 mol·L-1的Na2S2O3溶液6.00 mL,恰好反应完全。(已知:I2+2S2O32-= 2I-+S4O62-)
(1)书写步骤②中反应的离子方程式:_______________________________。
(2)步骤③中判断反应恰好完全的现象是_____________________________。
(3)上述实验样品中碘元素的含量是_________________mg/g(以含w的代数式表达)。
Ⅱ.海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。下图是实验室从海带
(含I-)中提取碘单质的流程图。

(1)步骤①中灼烧海带用到的实验仪器是__________(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
(2)步骤②的实验操作包括_____________。步骤④中分液所用的玻璃仪器是____、烧杯。
(3)步骤③中反应的离子方程式是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com