
分析 ①根据v=$\frac{△c}{△t}$计算v(C),再利用速率之比等于化学计量数之比计算x值;根据方程式计算参加反应A的物质的量,进而计算剩余A的物质的量,根据c=$\frac{n}{V}$计算.
②浓硫酸增重1.8g为水的质量,碱石灰增重2.2g为二氧化碳的质量,根据n=$\frac{m}{M}$计算二氧化碳、水的物质的量,根据n=$\frac{V}{{V}_{m}}$计算氧气的物质的量,根据质量守恒计算CO的质量,计算CO物质的量,根据原子守恒计算碳原子物质的量,根据氧原子守恒3gA中氧原子的物质的量,确定该物质的最简式,据此解答.
解答 解:①v(C)=$\frac{\frac{2mol}{2L}}{5s}$=0.2mol/(L•s),速率之比等于化学计量数之比,则2:x=0.2:0.3,故x=3;
参加反应A的物质的量为2mol×$\frac{3}{2}$=3mol,故剩余A的物质的量为6mol-3mol=3mol,其浓度为$\frac{3mol}{2L}$=1.5mol/L,故答案为:3;1.5;
②浓硫酸增重1.8g为水的质量,n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,
碱石灰增重2.2g为二氧化碳的质量,n(CO2)=$\frac{2.2g}{44g/mol}$=0.05mol,
1.68L氧气的物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,氧气的质量=0.075mol×32g/mol=2.4g
故CO的质量=3g+2.4g-1.8g-2.2g=1.4g,故 n(CO)=$\frac{1.4g}{28g/mol}$=0.05mol,
故3g A中n(H)=2n(H2O)=0.2mol,n(C)=n(CO2)+n(CO)=0.05mol+0.05mol=0.1mol,
n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×0.05 mol+0.05 mol+0.1mol-2×0.075 mol=0.1mol,
所以,n(C):n(H):n(O)=0.1mol:0.2mol:0.1mol=1:2:1,有机物最简式为CH2O,最简单的有机物为甲醛,分子式为CH2O,
故答案为:CH2O.
点评 本题属于拼合型题目,涉及化学反应速率有关计算、有机物分子式有关计算,难度不大,侧重对基础知识的巩固.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g S2-中电子数目为2NA | |
| B. | 46g NO2和N2O4的混合物中含有的原子数为3NA | |
| C. | 1L 0.5mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | 78g Na2O2中阴离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
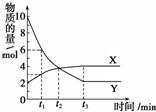 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为4X?Y | |
| B. | t2时,正反应速率等于逆反应速率 | |
| C. | t3时,Y浓度不再变化,反应达到平衡 | |
| D. | 当t1=2时,用X表示该反应在2 min内的平均反应速率为0.25mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子 | |
| C. | 沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+ | |
| D. | 加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4•H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体时,应往沸水中逐滴加lmol•L-l的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 | |
| B. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 用托盘天平准确称取5.85g NaCl固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com