
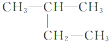 ,
,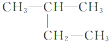 ;
;

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
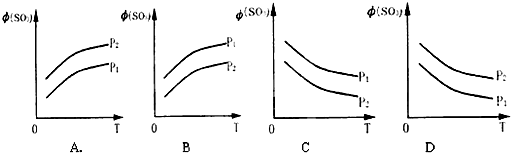
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | A | B | K | |||||
| 3 | C | D | E | F | G | H | I | |
| 4 | J |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| D | E | G | |||||||||||||||
| J | L | ||||||||||||||||
| M | Q | ||||||||||||||||
| 化学键 | G-J | J-J | G=G |
| 键能/(KJ?mol-1) | 460 | 176 | 497 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
| B、向0.1mol?L-1的FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有漂白性 |
| C、将碘水倒入分液漏斗中,加入适量乙醇,振荡后静置,可降碘萃取到乙醇中 |
| D、向锌粒与稀H2SO4的反应溶液中加入CuSO4,产生气泡的速度加快,说明CuSO4对此反应有催化作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com