
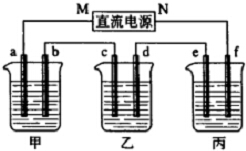
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.分析 乙烧杯中c电极附近溶液变红,则c是阴极,所以d是阳极,e是阴极,f是阳极,N是正极,M是负极,a是阴极,b是阳极,丙中为Na2SO4,相当于电解水,甲中a极上发生反应:Cu2++2e-=Cu,b电极上发生反应Cu-2e-=Cu2+,两电极质量差为25.6克,所以消耗金属铜和生成的金属铜都是12.8g,即0.2mol,所以整个电路转移电子是0.4mol,根据电解反应结合电子守恒进行计算即可.
解答 解:乙烧杯中c电极附近溶液变红,则c是阴极,所以d是阳极,e是阴极,f是阳极,N是正极,M是负极,a是阴极,b是阳极,甲中a极上发生反应:Cu2++2e-=Cu,b电极上发生反应Cu-2e-=Cu2+,两电极质量差为25.6克,所以消耗金属铜和生成的金属铜都是12.8g,即0.2mol,所以整个电路转移电子是0.4mol,
(1)电源的N端为是正极,丙烧杯中f电极是阳极,氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,乙烧杯中电解氯化钠发生反应的离子方程式为 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;电极c上发生电极反应:2H++2e-=H2↑;整个电路转移电子是0.4mol,所以生成氢气是0.2mol,生成的气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:正;4OH--4e-=2H2O+O2↑;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;4.48L;
(2)若甲烧杯中实现在铁表面镀铜,则精Cu作阴极,粗铜作阳极,所以a电极材料为精Cu,a极的电极反应为Cu2++2e-=Cu,故答案为:精Cu;Cu2++2e-=Cu;
(3)电解后,丙中电解掉了水,转移0.4mol的电子消耗0.2mol的水,质量是3.6g,电解后丙中Na2SO4溶液的质量分数=$\frac{100×10%}{100-3.6}×100%$=10.37%,故答案为:10.37%;
(4)由方程式可知Pb+PbO2+2H2SO4=2PbSO4+2H2O,转移电子0.4mol,消耗0.4mol硫酸,故答案为:0.4.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
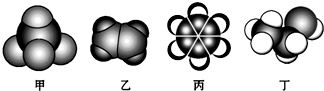
| A. | 甲中有少量乙杂质,可以通入到酸性高锰酸钾溶液中,洗气除杂 | |
| B. | 乙烷中有少量乙杂质,可以通入到溴水中,洗气除杂 | |
| C. | 丙中有少量苯酚杂质,可以先加浓溴水,然后静置,过滤除杂 | |
| D. | 丁有少量乙酸杂质,可以加少量浓硫酸并加热除杂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al、S的还原性依次增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
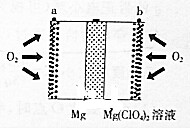 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )| A. | 放电时Mg在负极被ClO4-氧化 | |
| B. | 正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 | |
| D. | 理论上外电路流过1mol电子时电池总质量增加8.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
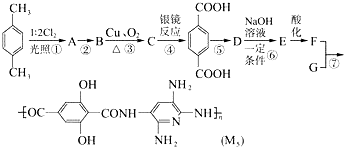
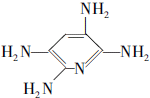 ,F的含氧官能团的名称有羧基、(酚)羟基.
,F的含氧官能团的名称有羧基、(酚)羟基.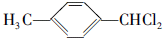 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有18列,即18个族 | |
| B. | 目前使用的元素周期表中,最长的周期含有32种元素 | |
| C. | 短周期元素是指1~20号元素 | |
| D. | 原子的种类和元素的种类一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com