
(10分)
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+)∶c(HC2O4-)接近1∶1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol·L-1 H2SO4溶液酸化后,用0.10mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)

共10分。
(1)AC(2分) (2)①CO2(2分) ②1∶3(2分)
(3)被点燃的气体为CO,质量为m(CO) =36.0 g-13.6 g-7.2 g-11.0 g = 4.2 g;
又FeC2O4·2H2O为0.2 mol,n(H2O)= 7.2 g÷18 g/mol = 0.4 mol,
n(CO2)= 11.0 g÷44 g/mol = 0.25 mol,n(CO)= 4.2 g÷28 g/mol = 0.15 mol,
所以,残留固体中所含元素及物质的量为n(Fe) = 0.2 mol,n(O) = 0.15 mol,
则残留固体为Fe和FeO的混合物,其中Fe为0.05 mol,FeO为0.15 mol(4分)
(答残留固体为0.05 mol Fe4O3的也给分)


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
(10分)乙二酸(HOOC-COOH)俗称草酸,该酸广泛存在于多种植物的细胞膜内,其晶体通常含有结晶水(H2C2O4·2H2O),晶体的熔点为101.5℃,无水草酸的熔点为189.5℃。草酸易升华,其在157℃时大量升华,并开始分解,分解产物为CO、CO2、H2O。
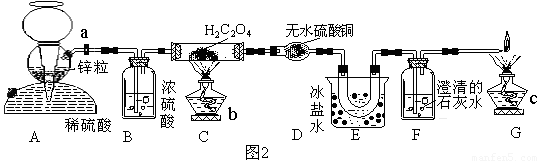
某研究性学习小组的同学决定对草酸的分解反应进行探究,设计出如下实验验证乙二酸的分解并测定其分解率,操作步骤如下:
①先把乙二酸晶体放在烘箱中进行烘烤,去掉结晶水,备用。
②按图2连接好装置。
③检查装置的气密性。
④打开活塞a,通入H2一会儿,再关闭a;点然酒精灯b、c。
⑤当C装置中固体消失后,停止加热
⑥打开活塞a,继续通入H2,直至冷却。
试回答下列问题:
⑴装置A的作用______________________________,B的作用_____________________;装置E的作用_____________________________。
⑵检验该套装置的气密性的方法是____________________________________________。
⑶若分解结束后,不再通入氢气,会使所测的乙二酸的分解率_________(填“增大”、“减小”或“不变”)。
⑷可以代替装置G的方法是_____________________________________________。
⑸若称取H2C2O4(烘干)的质量为4.5g,实验结束后,称得D、E、F分别增重0.95g、0.40g、1.98g,则乙二酸的分解率为_______________。
查看答案和解析>>
科目:高中化学 来源:2010届靖江高级中学高三第三次模拟考试化学试题 题型:实验题
(10分) 二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂,常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高、二氧化氯的水溶液质量分数高于30%等均有可能引起爆炸。某研究小组设计下图所示实验装置制备ClO2。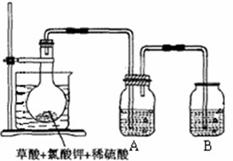
现称取12.25gKClO3和9g草酸(H2C2O4)放入烧瓶中,然后再加入足量的稀硫酸,水浴加热。
回答下列问题:
(1)已知反应后的产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃~
80℃之间。这样操作的目的是 ,
图示装置中缺少的一种必须的玻璃仪器是 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 (填序号)。
a. 50mL 60℃的温水 b. 50mL冰水 c. 50mL饱和食盐水 d. 50mL NaOH溶液
(4)本实验所制得的二氧化氯水溶液质量分数约为 。(小数点后保留两位)
(5)二氧化氯可迅速氧化硫化物,以除去有机硫产生的臭味,改善水产养殖水体的水质。取适量二氧化氯溶液加入到硫化氢溶液中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。硫化氢溶液与二氧化氯发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010郯城县高考补习学校第二次质量检测 题型:实验题
(10分)乙二酸(HOOC-COOH)俗称草酸,该酸广泛存在于多种植物的细胞膜内,其晶体通常含有结晶水(H2C2O4·2H2O),晶体的熔点为101.5℃,无水草酸的熔点为189.5℃。草酸易升华,其在157℃时大量升华,并开始分解,分解产物为CO、CO2、H2O。
某研究性学习小组的同学决定对草酸的分解反应进行探究,设计出如下实验验证乙二酸的分解并测定其分解率,操作步骤如下:
①先把乙二酸晶体放在烘箱中进行烘烤,去掉结晶水,备用。
②按图2连接好装置。
③检查装置的气密性。
④打开活塞a,通入H2一会儿,再关闭a;点然酒精灯b、c。
⑤当C装置中固体消失后,停止加热
⑥打开活塞a,继续通入H2,直至冷却。
试回答下列问题:
⑴装置A的作用______________________________,B的作用_____________________;装置E的作用_____________________________。
⑵检验该套装置的气密性的方法是____________________________________________。
⑶若分解结束后,不再通入氢气,会使所测的乙二酸的分解率_________(填“增大”、“减小”或“不变”)。
⑷可以代替装置G的方法是_____________________________________________。
⑸若称取H2C2O4(烘干)的质量为4.5g,实验结束后,称得D、E、F分别增重0.95g、0.40g、1.98g,则乙二酸的分解率为_______________。
查看答案和解析>>
科目:高中化学 来源:2010年北京市西城区高二下学期期末考试化学试题 题型:填空题
(10分) 莽草酸具有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体。莽草酸可以实现下列转化:

已知:①

请回答下列问题。
(1)A的结构简式是 。
(2)B C的化学方程式是
C的化学方程式是
。
反应类型是 反应。
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原
子。E分子中手性碳原子有 个。
(4)莽草酸经过中间产物D合成E的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com