
【题目】过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是_____。
A.铜元素焰色反应的光谱为吸收光谱
B.金属键没有方向性和饱和性
C.基态铁原子核外未成对电子有4个
D.锌属于过渡元素,处于元素周期表的d区
(2)[Co(NH3)5Br](NO3)3是钻元素形成的一种配位化合物。
①该配位化合物中心离子的价电子排布式为___,中心离子的配位数为____。
②该配位化合物中含氮离子的中心原子的杂化类型为______。
(3)①一种铝镍合金的结构如图,与其结构相似的化合物是_____。

a.氯化钠
b.氯化铯
c.石英
d.金刚石
②NiO、CoO的晶体结构均属于NaC1型(Ni2+和Co2+的半径分别为69pm和74pm),NiO的熔点比CoO高,其原因是____。
③已知CuO![]() Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____。
Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____。
(4)Cu与H可形成一种红色晶体,其晶胞结构如图所示,则该化合物的化学式为____,一个晶胞的质量为_____g(NA为阿伏加德罗常数的值)。

【答案】BC 3d5 6 sp2 b NiO、CoO均为离子晶体,Ni2+、Co2+所带电荷数相同,Ni2+比Co2+的半径小,形成的离子键强,晶格能大 Cu+的3d能级有10个电子,处于较稳定的全充满状态,则Cu2+不如Cu+稳定 CuH ![]()
【解析】
(1)A.焰色反应为原子的发射光谱;
B.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此金属键没有方向性和饱和性;
C.根据基态铁原子的价电子排布式为3d64s2判断;
D.根据元素在周期表的分区作答;
(2)①根据化合价代数和为零,判断钴离子的电荷数,从而确定其价电子排布式;其中NH3、Br-均为中心离子的配体,配位数为6;
②该配位化合物中含氮离子为NO3-,计算价层电子对数,即可判断中心原子的杂化类型;
(3)①根据“均摊法”确定铝镍合金的化学式,以及阴阳离子的配位数,再以此进行比较;
②离子晶体的晶格能越大,熔沸点越高;
③Cu+的3d能级有10个电子,处于较稳定的全充满状态,而Cu2+不如Cu+稳定;
(4)根据“均摊法”确定该晶体的化学式;再计算晶胞的质量。
(1)A.当金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因此铜元素焰色反应的光谱为发射光谱,A项错误;
B.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此金属键没有方向性和饱和性,B项正确;
C.基态铁原子的价电子排布式为3d64s2,在3d轨道上有4个未成对电子,C项正确;
D.锌属于过渡元素,处于元素周期表的ds区,D项错误;
故答案为:BC;
(2)①钴离子的化合价为+4价,钴离子核外有23个电子,其价电子排布式为3d5;
中心离子钴离子的的配位数为6;
故答案为:3d5;6;
②该配位化合物中含氮离子为NO3-,孤电子对数为(5+1-3×2)/2=0,σ键电子对数为3,,价层电子对数为3+0=3,则中心原子的杂化类型为sp2;
故答案为:sp2;
(3)①由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×1/8
=1,其化学式为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,a.氯化钠中每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,不符合;
b.氯化铯中每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,符合;
c.石英为空间立体网状结构,硅原子周围有4个氧原子,氧原子周围有2个硅原子,不符合;
d.金刚石为空间立体网状结构,每C原子周围有4个C原子,不符合;
故答案为:b;
②NiO、CoO均为离子晶体,Ni2+、Co2+所带电荷数相同,Ni2+比Co2+的半径小,形成的离子键强,晶格能大,则NiO的熔点比CoO高;
故答案为:NiO、CoO均为离子晶体,Ni2+、Co2+所带电荷数相同,Ni2+比Co2+的半径小,形成的离子键强,晶格能大;
③Cu+的3d能级有10个电子,处于较稳定的全充满状态,而Cu2+不如Cu+稳定;
故答案为:Cu+的3d能级有10个电子,处于较稳定的全充满状态;而Cu2+不如Cu+稳定;
(4)观察晶胞结构知,12个顶点上(顶点上原子为6个晶胞共用)各有一个Cu、上下两个面中心各有一个Cu、晶胞体内有3个Cu,则一个晶胞内Cu原子的个数为12×1/6+2×1/2+3=6;6个棱上(棱上原子为3个晶胞共用)各有一个H,体内有4个H,故一个晶胞内H原子的个数为6×1/3+4=6;则化学式为CuH,一个晶胞的质量为![]() ;
;
故答案为:CuH;![]() 。
。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】指出下列化学反应类型(氧化、酯化、加成、取代)
(1)CH2Cl2+Br2![]() CHBrCl2+HBr _____________
CHBrCl2+HBr _____________
(2)CH2=CH2+Br2→CH2BrCH2Br __________
(3)![]() +HNO3
+HNO3![]()
![]() NO2 +H2O _______________
NO2 +H2O _______________
(4)![]() ___________
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列叙述正确的是( )
A.含1mol乙酸的溶液中H+数等于0.1NA
B.标准状况下,22.4L乙醇的分子数为NA
C.28g乙烯和丙烯所含碳氢键的数目为4NA
D.1 mol甲基所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃 R—CH2—CH2—X 中化学键如图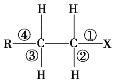 所示,则下列说法正确的是()
所示,则下列说法正确的是()
A. 发生水解反应时,被破坏的键是①和③
B. 发生消去反应时,被破坏的键是①和④
C. 发生水解反应时,被破坏的键是①
D. 发生消去反应时,被破坏的键是①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
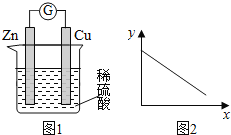
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大。A、E元素的原子最外层均只有一个电子,且A和E可形成离子化合物;B是组成有机化合物的核心元素;C的单质是空气中含量最多的气体;D原子的最外层电子数是其内层电子数的3倍;F和D同主族。请回答:
(1)A、D、E组成的化合物的电子式为_____。
(2)B元素在周期表中的位置是__,由它组成的一种同素异形体属于原子晶体,其名称为___。
(3)C、D的简单氢化物中热稳定性较强的物质的化学式为____。
(4)E、F的最高价氧化物对应的水化物之间反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
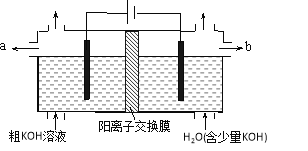
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com