
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
分析 (1)根据仪器的用途选取仪器;
(2)根据NaOH的体积,第3次数据显然误差较大,舍去;另外三次所用NaOH平均体积为20 mL,代入计算;
(3)部分电离的电解质是弱电解质;
(4)醋酸浓度越小,醋酸的电离程度越大;
(5)探究温度对醋酸的电离程度的影响,应控制其他条件相同,只有温度存在差异的醋酸溶液H+浓度有差异,能够对溶液中H+浓度区分度较好的仪器是pH计.
解答 解:(1)根据仪器的用途选取仪器,用胶头滴管定容,用250mL容量瓶配制溶液,
故答案为:胶头滴管;250 mL容量瓶;
(2)根据NaOH的体积,第3次数据显然误差较大,舍去;另外三次所用NaOH平均体积为20.00mL,
则醋酸溶液浓度=$\frac{0.2000mol/L×0.02L}{0.02L}$=0.2000 mol/L,
故答案为:0.2000 mol/L;
(3)孤立的看每次测量值,H+浓度远小于醋酸的浓度,说明醋酸不完全电离;联系起来看,浓度为0.100 0 mol•L-1、0.010 0 mol•L-1及0.001 0 mol•L-1的醋酸,pH变化值小于1,所以醋酸是弱电解质,
故答案为:0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1;
(4)以0.100 0 mol•L-1、0.010 0 mol•L-1醋酸为例,设0.100 0 mol•L-1的醋酸溶液体积为1 L,将其稀释至0.010 0 mol/L,体积变为10 L,两溶液中H+的物质的量分别为:10-2.88 mol、10-2.38 mol,可见溶液变稀,电离出的H+的物质的量增大,故说明醋酸的电离程度增大,可以可得出的另一个结论为:随着醋酸浓度的减小,醋酸的电离程度增大,
故答案为:随着醋酸浓度的减小,醋酸的电离程度增大;
(5)探究温度对醋酸的电离程度的影响,应控制其他条件相同,只有温度存在差异的醋酸溶液H+浓度有差异,能够对溶液中H+浓度区分度较好的仪器是pH计,
故答案为:用pH计(或精密pH试纸)测定相同浓度的醋酸在几种不同温度时的pH.
点评 本题考查了弱电解质电离及实验探究,明确弱电解质电离特点是解本题关键,难点是实验设计,设计实验时要注意只改变一个条件,为易错点,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 仪器装置 | 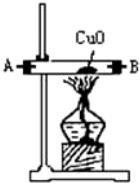 |  | 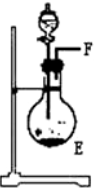 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | 加碱加热产生使湿润红色石蕊试纸变蓝的气体 | 溶液中含有NH4+ |
| B | 加BaCl2溶液有白色沉淀,加稀硝酸沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 加KSCN溶液无现象•再滴加氯水变血红 | 溶液中有Fe2+ |
| D | 加热时.铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
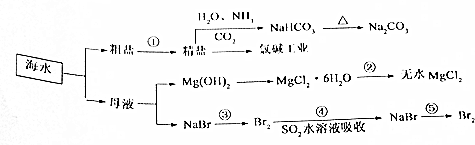
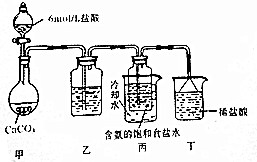
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②混合后c(H+)=c(CH3COO-)+c(OH-)+2c(SO42-) | |
| B. | ①和④溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.01mol•L-1 | |
| C. | ②和③混合溶液中:c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 四种溶液各稀释100倍,溶液pH:④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在容器中共存 | ||
| C. | P、Q的反应速率相等内部 | D. | P、Q、R、S的浓度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com