
����Ŀ��1902��¹���ѧ�ҹ����о����ϳɰ��ķ�����
��1��ij�¶�ʱ��N2��H2��Ӧ�����淴Ӧ�������е������仯��ͼ1��ʾ�� 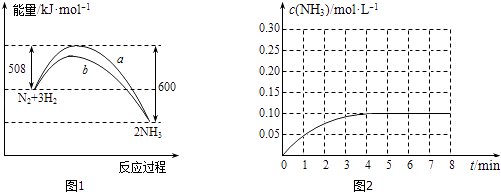
��д���ϳɰ����Ȼ�ѧ����ʽ ��
������������ȷ���� ��
A��b�����Ǽ������ʱ�������仯����
B�����ܱ������м���28gN2��6gH2 �� ��ַ�Ӧ�ų�������С��92kJ
C����ͼ��֪���Ͽ�1molN��N����3molH��H�����յ�������С���γ�6molN����������ų�������
D����Ӧ������������������������
��2����һ�ݻ�Ϊ4L���ܱ������У�����0.4molN2��1.2molH2 �� ��һ�������·�����Ӧ����Ӧ��NH3�����ʵ���Ũ�ȱ仯�����ͼ2��ʾ����ͼ����ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ������H2��Ϊmol/��Lmin����ƽ��ʱ��c��N2��Ϊ ��
��3��������֤ʵN2��H2�ڹ��������Fe�����������ͽ����Ժϳɰ��Ĺ��̶���ŵ������������ ![]() �ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ��ʾ������������״̬��ߵ���������ĸ��ţ���
�ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ��ʾ������������״̬��ߵ���������ĸ��ţ��� 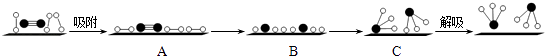
���𰸡�
��1��N2��g��+3H2��g��?2NH3��g����H=��92KJ/mol��abc
��2��0.0375��0.05mol/L
��3��B
���������⣺��1���١�H=�ų������������յ�����=508KJ/mol��600KJ/mol=��92KJ/mol�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��2NH3��g����H=��92KJ/mol��
���Դ��ǣ�N2��g��+3H2��g��2NH3��g����H=��92KJ/mol����A��ʹ�ô����ܽ������淴Ӧ�Ļ�ܣ������ܸı䷴Ӧ����ЧӦ����b�����Ǽ������ʱ�������仯���ߣ���a��ȷ��B�����ںϳɰ��ķ�ӦΪ���淴Ӧ�����ܽ��г��ף������ܱ������м���28gN2��6gH2 �� ��ַ�Ӧ�ų�������С��92kJ����b��ȷ��C����ͼ��֪���Ͽ�1molN��N����3molH��H�����յ�������Ϊ508KJ��С���γ�6molN����������ų�������600KJ����c��ȷ��D����ͼ��֪����Ӧ����������������������������Ӧ���ȣ���d����ѡabc����2������ͼ�����ƽ��ʱ������Ũ��Ϊ0.1mol/L��ʱ��Ϊ4min��������������֮�ȵ���ϵ��֮�ȵõ���v��H2��=v��NH3��= ![]() ��
�� ![]() =0.0375 mol/��Lmin����ƽ��ʱ������Ũ��Ϊ0.1mol/L������c��NH3��=0.1mol/L����Ũ�ȵĸñ���֮�ȵ��ڼ�����֮�ȣ��ʡ�c��N2��=0.05mol/L���������ij�ʼŨ��Ϊ0.1mol/L����ƽ��ʱ��c��N2��Ϊ0.05mol/L�����Դ��ǣ�0.0375��0.05mol/L����3�����ڻ�ѧ���Ķ���Ҫ�����������ʻ״̬B���������ڳ�ʼ״̬A�����������˷�ӦΪ���ȷ�Ӧ���ʳ�ʼ״̬A����������ĩ̬C����������B��������ߣ�
=0.0375 mol/��Lmin����ƽ��ʱ������Ũ��Ϊ0.1mol/L������c��NH3��=0.1mol/L����Ũ�ȵĸñ���֮�ȵ��ڼ�����֮�ȣ��ʡ�c��N2��=0.05mol/L���������ij�ʼŨ��Ϊ0.1mol/L����ƽ��ʱ��c��N2��Ϊ0.05mol/L�����Դ��ǣ�0.0375��0.05mol/L����3�����ڻ�ѧ���Ķ���Ҫ�����������ʻ״̬B���������ڳ�ʼ״̬A�����������˷�ӦΪ���ȷ�Ӧ���ʳ�ʼ״̬A����������ĩ̬C����������B��������ߣ�
���Դ��ǣ�B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��X��Y��ZΪ������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ����4��Ԫ�ص�ԭ������������֮��Ϊ22������˵����ȷ����
![]()
A. Y��ԭ�Ӱ뾶��X�Ĵ�
B. Q������������ˮ��������Ա�Z��ǿ
C. X��Y����3��Ԫ���γɵĻ������ж�ֻ�й��ۼ�
D. Q�ĵ��ʾ��а뵼������ʣ�Q��Z���γɻ�����QZ4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ���������ݻ���Ϊ1 L�ĺ����ܱ������н�������Ӧ: 2NO2(g)![]() 2NO(g)+O2(g) (����Ӧ����)��ʵ����:v��=v(NO2)����=k��c2(NO2)��v��=v(NO)����= 2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
2NO(g)+O2(g) (����Ӧ����)��ʵ����:v��=v(NO2)����=k��c2(NO2)��v��=v(NO)����= 2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
������� | ���ʵ���ʼŨ��(mol/L) | ���ʵ�ƽ��Ũ��(mol/L) | ||
c (NO2) | c (NO) | c (O2) | c(O2) | |
�� | 0.6 | 0 | 0 | 0.2 |
�� | 0.3 | 0.5 | 0.2 | |
�� | 0 | 0.5 | 0.35 | |
A. ��ƽ��ʱ�����������������е���ѹǿ֮��Ϊ4��5
B. ��ƽ��ʱ����������c(O2)/ c(NO2)���������еĴ�
C. ��ƽ��ʱ����������NO���������С��50%
D. ���¶ȸı�ΪT2ʱ����k��=k������T2>T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڵ���ʵ���(����)
A. ˮ�� B. ����� C. �ƾ� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��θ�����ɷ��ÿ���ҩ���Ի��⣬����������ҩ��Ч�ɷֵ���
A.ˮ����B.��C.̼������D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ǿ����ȫ������ij�Ϳ�������һ̨���������ͺ����IJ����ǣ��乤��ԭ����ͼ��ʾ����ǿ������Һ���������Һ��������˵���в���ȷ����

A. ʯī�缫��������������ԭ��Ӧ
B. ���缫�ĵ缫��ӦʽΪ��C8H18+16H2O-50e-=8CO2+50H+
C. H+�����ӽ���Ĥ������Ҳ�Ǩ��
D. ÿ���ı�״����5.6 L O2��Һ��ͨ��lmol ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
�����ܸı仯ѧ��Ӧ�����ʣ�ԭ���Ǹı仯ѧ��Ӧ��·����ijͬѧ��ʵ���з��֣���2mL5%H2O2��Һ�зֱ����FeCl3��FeCl2��Һ�������������������ݣ���Ӧ�����Һ�е��뼸��KSCN��Һ����Һ����Ϊ��ɫ����������֪��FeCl3��H2O2�ֽ��з������·�Ӧ��
��2Fe3++H2O2�T2Fe2++2H++O2�� ��2Fe2++2H++H2O2�T2Fe3++2H2O
��1���ڷ�Ӧ����Fe3+�����ڷ�Ӧ����Fe3+�� �� ��ͬѧ��ΪFe2+Ҳ����H2O2�ֽ�Ĵ���������Ϊ�ù۵��Ƿ���ȷ������������
��
��2����Ӧ2MnO4��+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O����������MnSO4���������Թ۲쵽��Һ��ɫ��ȥʱ���̣����Թ��м���4mL0.01mol/LKMnO4������Һ��2mL0.1mol/LH2C2O4��Һ��ʵ���ʼ��ʱ�䩁����ͼ���������ͼ1�е�������ţ��� 
��3��ij��Ӧ��ϵ�д���A��B��C��D�������ʣ���Ӧ�����и����ʵ����ʵ����仯��ͼ2��ʾ����д���÷�Ӧ�Ļ�ѧ����ʽ ��
��4����������������SO2�����������ᣮ��֪25�桢101kPaʱ��
2SO2��g��+O2��g���T2SO3��g����H1=��197kJmol��1��
H2O��g���TH2O��l����H2=��44kJmol��1��
2SO2��g��+O2��g��+2H2O��g���T2H2SO4��l����H3=��545kJmol��1 ��
��SO3��g����H2O��l����Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ��������19.2g����֪����ֻ����ԭΪNO���壩������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ�����з�����������ȷ���ǣ� �� 
A.ͼ�У�AB�εķ�ӦΪFe+2Fe3+=3Fe2+ �� ��Һ����������ΪFeSO4
B.ԭ��Һ��H2SO4Ũ��Ϊ2.5molL��1
C.ԭ�����Һ��NO3�������ʵ���Ϊ0.4mol
D.ͼ�У�OA�β�����������NO��BC�β���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�����������dz���Ҫ������H2O��������ȷ���ǣ� ��
A.���зǼ��Լ��ͼ��Լ�
B.��ˮ���������磬���ڷǵ����
C.������IJ������ӽ���ˮ���ᷢ��ƫת
D.ˮ���Ӽ������������Լ��Ⱥ��ѷֽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com