
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是( )
A.M元素存在同素异形体
B.M元素为非金属元素
C.M的最高价氧化物对应的水化物都是强酸
D.常温下,能稳定存在的M的氧化物都是酸性氧化物
科目:高中化学 来源: 题型:
将15ml.2mol/LNa2CO3溶液逐滴加入到40 ml.0.5mol/LMCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是 ( )
A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图:

关于该过程的相关叙述正确的是( )
|
| A. | 反应④的反应类型是缩聚反应 |
|
| B. | 物质A是卤代烃 |
|
| C. | 物质B催化氧化后可以得到乙醛 |
|
| D. | 1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于摩尔的说法中,正确的是( )
A.摩尔是表示物质质量的单位
B.摩尔是七个基本物理量之一
C.摩尔是表示物质的数量的单位
D.摩尔是物质的量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.四种元素的原子半径:rZ>rX>rY>rW
B.X、Y、Z、W形成的单质最多有6种
C.四种元素均可与氢元素形成18电子分子
D.四种元素中,Z的最高价氧化物对应水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
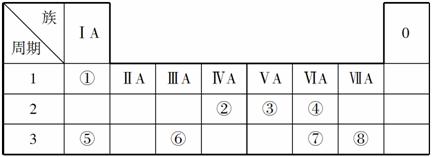
(1)请画出元素⑥的离子结构示意图:________。
(2)元素⑦中质子数和中子数相等的同位素符号是____________。
(3)④⑤⑦的简单离子半径由大到小的顺序为____________。
(4)②的最高价氧化物对应水化物的电离方程式为__________________。
(5)④⑤两种元素的原子按1:1组成的常见化合物的电子式为________。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为____________________。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16 g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量,写出A与B反应的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4 ·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。
·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。
实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是_______________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+, 离子方程式如下:
离子方程式如下:
Cr2O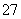 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________________________________和__________________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________ mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填选项字母)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
处于平衡状态的反应2 H2 S(g)  2H2(g)+S2(g)
2H2(g)+S2(g)  H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变, H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com